
【题目】化学反应中伴随着能量变化。
(1)下列反应中,属于吸热反应的是 (填序号)。
A.燃烧CO
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
C.铝和稀盐酸反应
D.NaOH溶液和稀盐酸反应
(2)按下图所示装置进行实验。

【实验现象】反应剧烈,火星四射,漏斗下方有红热熔融物流出。由此判断该反应是 (填“吸热”或“放热”)反应,其反应的化学方程式是 ,其能量变化可用下图中的 (填“a”或“b”)表示。

科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是__________________________;A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________________。分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是________________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强是________________(用具体的化学键表示)。
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是_______。
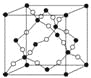
a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列共有十二种化学符号:
①O2 ②![]() C ③238U ④
C ③238U ④![]() Na ⑤O3 ⑥
Na ⑤O3 ⑥![]() N ⑦
N ⑦![]() Mg ⑧
Mg ⑧![]()
⑨235U ⑩![]()
![]()
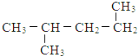
![]()
其中:
(1)表示核素的符号共有___种。
(2)互为同位素的是___(填序号,以下相同)。
(3)质量数相等,但不能互称同位素的是__。
(4)中子数相等,但质子数不相等的是___。
(5)互为同素异形体的是___。
(6)互为同分异构体的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法正确的是( )
A.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
B.氢氟酸保存在细口玻璃瓶中。
C.高纯度的硅单质广泛用于制作光导纤维
D.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
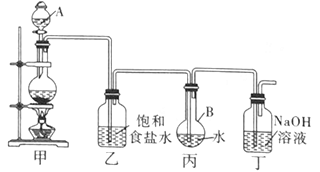
(1)写出装置甲中发生反应的化学方程式: 。
装置甲中的仪器使用前需要检漏的有 (写名称)。
(2)利用装置丙制取饱和氯水并测其pH值。
①证明氯水已饱和的现象是 。
②测定饱和氯水的pH方法是 。
③若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是 。
(3)饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
i.在试管中加入过量的块状碳酸钙,再加入约20ml饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
ii.过滤,将滤液滴在有色布条上,发现其漂白性更强;
iii.为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
② 试解释可以在饱和氯水中加入石灰石制备HClO的原因: 。(用有关的方程式结合文字回答)
②试根据所学知识推测,在ii的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为 (写化学式)。
③写出步骤iii中第一份滤液发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】
元素铝是在生产、生活中应用广泛的金属元素。
(1)氧化铝是一种耐高温材料,也是工业上制取铝的原料。从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下图所示:
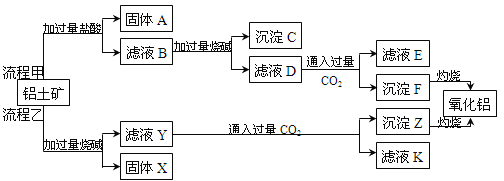
体A的主要成分是 (填化学式,下同),固体X的主要成分是 。
②滤液E中溶质的主要成分是 ,写出该溶质的一种用途: 。
③在滤液D中通入过量CO2时反应的离子方程式为 。
(2)工业上电解氧化铝冶炼铝时加入冰晶石(Na3AlF6)的作用是 。在电解池的工作过程中,需要不断补充阳极材料(石墨),原因是 。
(3)一种新型高效净水剂PAFC——聚合氯化铁铝[AlFe(OH)nCl6-n]m(n<5,m<10)可广泛应用于日常生活用水和工业污水的处理。下列有关PAFC的说法正确的是 (填序号)。
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同物质的量的氯化铝和氯化铁的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性或强碱性溶液中都能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
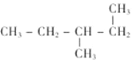
【题目】如下图表示4个碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是 ( )

A.图中属于烷烃的是A、C、H
B.图中C和F分子中氢原子数相同
C.图中物质碳元素的质量分数最大的是C
D.图中与B互为同分异构体的有E、F、H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com