
| 高温 |
| 高温 |
| m |
| M |
| m |
| M |
| V |
| Vm |
| m |
| M |
| 11.7g |
| 78g/mol |
| 11.7 |
| 78 |
| ||
| 90% |
| ||
| 90% |
| 高温 |
| 3mol×[6-(-2)] |
| 4 |
| 3mol×[6-(-2)] |
| 4 |
| 1 |
| 1+x |
| x |
| 1+x |
| 1 |
| 1+x |
| x |
| 1+x |
| x+2 |
| 4+4x |
| x+2 |
| 4+4x |
| 19.2g |
| 32g/mol |
| 2 |
| 3 |
| 1 |
| 3 |
| 2.24L |
| 22.4L/mol |
| 14.2g |
| 142g/mol |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| x+2 |
| 4+4x |
| x+2 |
| 4+4x |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 + 4C →高 温 Na2S + 4CO
② Na2SO4 + 4 CO→高 温 Na2S + 4CO2
(1)现要制取Na2S 7.8克,需要无水芒硝(Na2SO4) g;
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量范围n的范围是 < n < ;
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2 g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为 mol;Na2SO3的物质的量为 mol;Na2SO4的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2012届上海市崇明县高三高考模拟考试(二模)化学试卷(带解析) 题型:计算题
(共16分) 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 4C
4C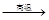 Na2S
Na2S 4CO↑
4CO↑
② Na2SO4 4CO
4CO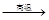 Na2S
Na2S 4CO2
4CO2
(1)、现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)、若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
<n< ;
(3)、若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y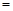 ;
;
(4)、Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 。
(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2012届三校上海市(复旦、交大、华师大二附中)高三联考化学试卷(带解析) 题型:计算题
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:Na2SO4+ 4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com