

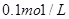 的NaOH溶液滴定
的NaOH溶液滴定 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
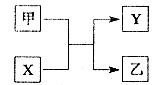
 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
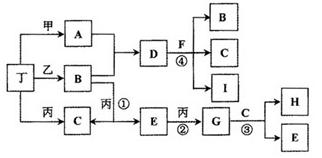
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
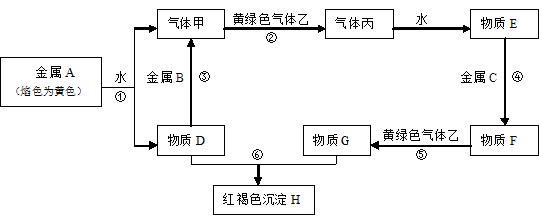
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.VIA族元素的原子,其半径越大,越容易得到电子 |
| C.室温时,零族元素的单质都是气体 |
| D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com