
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子 的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
【答案】D
【解析】
A.烷烃命名时,要选最长的碳链为主链,当有多条主链可选时,要选支链多的做主链,故此烷烃的主链上有5个碳原子,在2号碳原子上有一个甲基,在3号碳原子上有一个甲基和一个乙基,故名称为:2,3﹣二甲基﹣3﹣乙基戊烷,故A正确;
B.蛋白质遇浓的非重金属盐溶液会发生盐析,即溶解度降低而沉淀析出,故B正确;
C.![]() 中含酯基、醛基和苯环,含醛基和苯环,故能发生加成反应;含酯基,故能发生取代反应;含醛基,故能发生氧化反应,故C正确;
中含酯基、醛基和苯环,含醛基和苯环,故能发生加成反应;含酯基,故能发生取代反应;含醛基,故能发生氧化反应,故C正确;
D.该有机物含有三个双键,其芳香族同分异构体含有苯环,所以苯环的支链上不可能含有醛基,导致其芳香族同分异构体不能发生银镜反应,故D错误。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】已知粗盐水中含![]() ,含
,含![]() 。向粗盐水中加入
。向粗盐水中加入![]() 除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入
除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入![]() 除
除![]() 。
。
(1)处理上述粗盐水![]() ,至少需要加
,至少需要加![]() ________
________![]() 。(保留三位有效数字)
。(保留三位有效数字)
(2)如果用碳酸化尾气(含![]() 体积分数为0.100、
体积分数为0.100、![]() 体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2
体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2![]() 。处理上述
。处理上述![]() 粗盐水至少需要通入标准状况下________
粗盐水至少需要通入标准状况下________![]() 碳酸化尾气。(需列式计算,保留三位有效数字)
碳酸化尾气。(需列式计算,保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示, 已知:ICl中氯为-1价,碘为+1价。下列有关说法正确的是
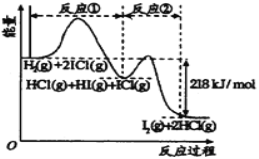
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,下列说法错误的是
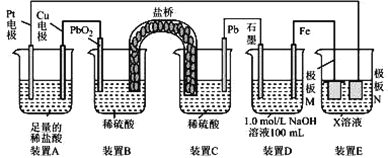
A.盐桥中的阳离子向装置B移动
B.装置A中总反应的离子方程式为 Cu+2H+ ![]() Cu2++H2 ↑
Cu2++H2 ↑
C.若在装置 D 中生成 0. 2 mol Fe(OH)3,则消耗水的物质的量共为0. 5mol
D.若装置E的目的是在Cu材料上镀银,则极板 N 的材料为Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4xH2O)的工艺流程如下:
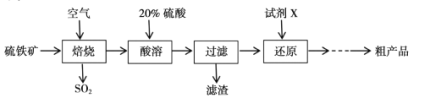
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____。
(2)写出酸溶过程主要反应的离子方程式____。
(3)试剂X是(写化学式)____。
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4xH2O)的操作是____
(5)利用如图装置测定FeSO4xH2O中结晶水含量:
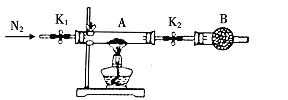
实验前通入N2,的主要目的是____,装置B中盛放的试剂是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年5月23日,《南阳日报》发消息称,“水氢发动机”在当地下线,文中称,“车载水可以实时制取氢气,车辆只需加水即可行驶。”文章发布后引发广泛质疑。据报道,该发动机的核心原理是用铝粉与水进行反应得到氢气,作为发动机的燃料。美军曾经报道过“尿氢能”技术,与“水氢汽车”的原理如出一辙,纳米铝粉加尿可得大量氢气,且用尿液与铝粉反应的产氢速率比正常的水高出一倍。下列说法不正确的是( )
A.常温下铝和水的反应不能自发反应,将铝加工为精细铝粉,增大了反应接触面积,使该反应变为自发反应
B.推测尿液与铝粉反应比水快的可能原因是因为尿液呈弱酸性,金属与酸反应速率加快
C.水作为铝的氧化剂的缺点是反应生成的氢氧化铝或氧化铝会吸附在铝表面,阻碍反应进行
D.若需得到标况下体积为10L的氢气,加入的铝粉至少为8.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上主要产钼国家之一,我国的钼资源十分丰富,以辉钼矿为主,是具有优势的战略资源。将辉钼矿精矿(主要成分为MoS2,杂质为CaCO3,SiO2,FeS2,CuFeS2,PbS等)除杂提纯可得到粗MoS2,通过精制转化最终可得到纯度更高的MoS2。
MoS2的相关信息:
①具有类似石墨的层状结构,有金属光泽,熔点1185℃,密度4.80g/cm-3,硬度很低,被广泛地应用在润滑领域。
②一般不溶于水、酸、碱和有机溶剂中,但溶于王水和煮沸的浓硫酸。Mo为+4价,在空气中加热至350℃以上开始被氧化,生成钼的氧化物。
有人提出了如下制取高纯MoS2的流程:
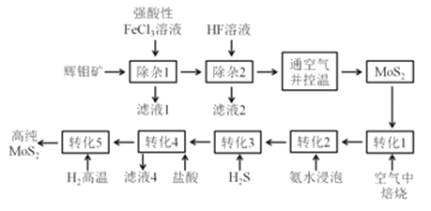
(1) MoS2可用作润滑添加剂的原因是:_____________。
(2)滤液1中存在的阳离子除H+、Ca2+、Pb2+外,还有:____________,写出“除杂1”过程发生的其中1个氧化还原反应的化学方程式:____________。
(3)“通空气并控温”这步操作的目的是:___________。必须控制好温度的原因:___________。
(4)“转化3”得到硫代钼酸铵(NH4)2MoS4。“转化4”中钼的化合价不变,产生气体和沉淀(二元化合物),写出该反应的离子方程式:____。
(5)上述流程中,哪些步骤发生了氧化还原反应:_____。
A.除杂1 B.除杂2 C.转化1 D.转化2 E.转化3 F.转化4 G.转化5
(6)上述流程中,可以循环使用的物质为(写化学式):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3和Cu2O是红色粉末,常作颜料。某校化学实验小组通过实验来探究红色粉末的成分是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是____;若假设2成立,发生反应的离子方程式为______。
(2)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,设计实验计算二者的物质的量:取一定量的该固体粉末溶于500 mL未知浓度的稀硫酸溶液中,固体全部溶解,向反应后的溶液中加入Fe粉,溶液中部分离子的物质的量随Fe粉加入,变化如图所示,则Fe2O3和Cu2O的物质的量分别为____、 _______。

(3)硫酸溶液的物质的量浓度是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com