
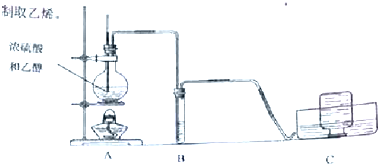
分析 (1)乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,加热乙醇与浓硫酸混合物容易发生爆沸;
(2)制备乙烯中含有杂质二氧化硫、二氧化碳,二者都能够与氢氧化钠溶液反应;
(3)乙烯含碳量高,燃烧时火焰明亮,有黑烟.
解答 解:(1)①乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,加热乙醇与浓硫酸混合物容易发生爆沸,加入碎瓷片的目的是防止爆沸;
故答案为:防暴沸;CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)制备乙烯中含有杂质二氧化硫、二氧化碳,二者都能够与氢氧化钠溶液反应,所以可以用氢氧化钠溶液除去乙烯中的二氧化硫、二氧化碳杂质气体;
故答案为:除去乙烯中的二氧化硫、二氧化碳等杂质气体;
(3)乙烯含碳量高,在空气中燃烧,火焰比较明亮且伴有少量黑烟;
故答案为:乙烯在空气中燃烧,火焰比较明亮且伴有少量黑烟.
点评 本题考查了乙烯的实验室制法和性质,明确乙烯制备原理和性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生银镜反应 | B. | 在一定条件下可氧化成羧酸 | ||
| C. | 与氢气加成只能生成丙醛 | D. | 可使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)取9.0g有机物A加热使其气化,测得其密度是相同条件下H2的45倍 | (1)由此可知A的相对分子质量为90. |
| (2)将9.0gA在足量O2中充分燃烧,其产物依次缓缓通过浓硫酸、碱石灰,两者分别增重5.4g和13.2g. | (2)由此可知A的分子式为C3H6O3. |
| (3)另取A9.0g,跟足量的NaHCO3粉末反应,生成CO2气体2.24L;9.0gA若与足量金属钠反应生成H2也是2.24L(气体体积皆为标准状况下测得). | (3)由此可知A中含有官能团有.(填结构简式)-COOH、-OH |
(4)A的核磁共振氢谱如下图: | (4)由此可知A中含有4种不同性质的氢原子 (5)综上,A的结构简式为  . . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-环己二烯比苯稳定 | |
| B. | 苯比1,3-环己二烯稳定 | |
| C. | 1,3-环己二烯加氢是吸热反应 | |
| D. | 苯加氢生成环己烷的反应中只有物质变化而无能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解产物为Cl2和Na | |
| B. | 电解过程中能产生黄绿色气体 | |
| C. | 电解一段时间后,将全部电解液转移到烧杯中,然后滴加酚酞溶液,溶液呈红色 | |
| D. | 用排水集气法可以收集到较纯净的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com