
分子式为C5H11OH的同分异构体共有(不考虑立体异构)( )
A.6种 B.7种 C. 8种 D.9种
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高二化学试卷(解析版) 题型:选择题
化合物丙由如下反应制得:
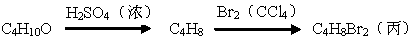
丙的结构简式不可能是( )
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。

(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
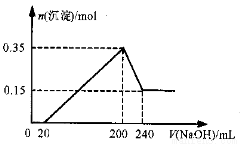
A.Mg和Al的总质量为8g
B.硫酸的物质的量浓度为5 mol/L
C.生成的H2在标准状况下的体积为11.2L
D.NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:填空题
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1) E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是
(用化学式表示);写出C与A形成的18e-化合物的电子式 ,
该化合物类型为 (填“共价化合物”或“离子化合物”)
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式
;写出题中生成M的化学方程式
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
A.a>b B. 平衡向正反应方向移动
C.A的转化率减小 D.B的质量分数减小
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:实验题
(14分)2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:
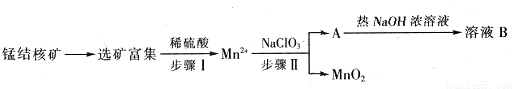
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
实验 | ① | ② | ③ | ④ |
V(HNO3)/ml | 50 | 100 | 150 | 200 |
V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
则:①m=________g。
②写出实验②发生反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:选择题
乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素 的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是( )
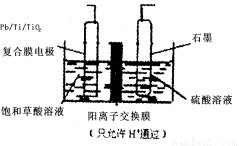
A.电解时石墨电极应与直流电的正极相连
B.阴极反应式为:HOOCCOOH+2H++2e- =OHCCOOH+H2O
C.电解时石墨电极上有O2放出
D.电解一段时间后,硫酸溶液的pH不变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com