
【题目】FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10—2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
【答案】除去废铁屑表面的油污 降低FeSO4在水中的溶解度,减少FeSO4·7H2O的损耗 用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口 c 酸式滴定管 滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色 16.8%
【解析】
(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解;
(2)由于硫酸亚铁的溶解度随温度的升高而增大;
(3)①转移液体需要引流;②硝酸有强氧化性,盐酸有还原性;高锰酸钾有强氧化性,应放在酸式滴定管中;滴定终点时,颜色变成紫红色,并且半分钟内不褪色;配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,以此计算;
(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,所以可用纯碱溶液除油污,故答案为:除去废铁屑表面的油污;
(2)由于硫酸亚铁的溶解度随温度的升高二增大,因此用冰水洗涤的另一个目的是减少洗涤过程中FeSO47H2O的损耗,故答案为:降低FeSO4在水中的溶解度,减少FeSO47H2O的损耗;
(3)①转移液体需要引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口,故答案为:用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口;
②硝酸有强氧化性,盐酸有还原性,能被高能酸钾氧化为氯气,只能用稀硫酸;高锰酸钾有强氧化性,能氧化橡皮管,应放在酸式滴定管中;滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点;故答案为:c;酸式;滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色;
③配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,反应需要的高锰酸钾的物质的量为![]() ×10-3L×1.2×10-2mol/L=18×10-5mol
×10-3L×1.2×10-2mol/L=18×10-5mol
则:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 18×10-5mol
n=18×10-5mol×5=90×10-5mol,则1.500g硫酸亚铁补血剂药片含铁的质量为90×10-5mol×5×56g/mol =0.252g,所以该补血剂中铁元素的含量为![]() ×100%=16.8%;
×100%=16.8%;
故答案为:16.8%。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有希望成为新能源汽车的电源,其结构如图所示,下列说法正确的是( )

A.电子从金属锂流出通过外电路流向石墨烯,固体电解质允许通过水
B.放电时,正极反应式:O2+4e-+4H+=2H2O
C.应用该电池电镀铜,阴极质量增加64g,理论上将消耗11.2LO2
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl 是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3, 含FeS、FeO 和SiO2杂质)制备CuCl 的某流程如下

下列说法不正确的是
A.H2O2将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-将溶液3 中的Cu2+还原,反应得到CuCl
D.若改变试剂加入顺序,将溶液3 缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() b
b ![]() 的
的![]() 溶液中滴加等体积的
溶液中滴加等体积的![]() 的NaOH溶液,充分反应后溶液中c
的NaOH溶液,充分反应后溶液中c![]() c
c![]() ,下列说法不正确的是
,下列说法不正确的是
A.b![]()
B.混合后溶液呈中性
C.向![]() 溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
D.![]() 的电离常数
的电离常数 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对大量盆栽鲜花施用了S﹣诱抗素制剂,以保持鲜花盛开,S﹣诱抗素的 分子结构如图,下列关于该分子的说法中正确的是( )
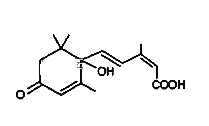
A.与氢气加成最多消耗氢气5mol
B.能发生加成反应、氧化反应、取代反应、缩聚反应
C.1mol该分子能与含2molNaOH的溶液完全反应
D.该分子能与溴水反应而使溴水褪色且1mol它能与溴水中的4molBr2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物种类繁多,请以你对有机物的认识填空:
(1)下列几组物质中,互为同位素的是__,互为同素异形体的是__,互为同系物的是___,互为同分异构体的是___。
①O2和O3;②35Cl和37Cl;③CH3CH3和CH3CH2CH3;④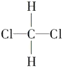 和
和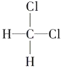 ;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥
;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥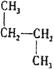 和
和![]() ;⑦
;⑦![]() 和CH3(CH2)3CH3;
和CH3(CH2)3CH3;
(2)下列各烷烃的沸点由高到低的顺序为___(用字母表示)
A.正戊烷 B.异戊烷 C.CH3(CH2)2CH3 D.新戊烷 E.C3H8
(3)聚乙烯可用于制造食品包装袋,由乙烯制备聚乙烯的化学方程式为___。
(4)丙烯中处于同一平面的原子最多有___个,丙烯使溴水褪色,其化学方程式为___,该反应的类型是___。
(5)1mol某烷烃完全燃烧时消耗氧气的物质的量为11mol,其化学式为___,其结构中含有3个-CH3的结构简式分别为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
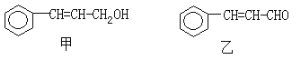
(1)乙中所含官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
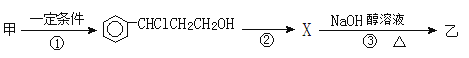
设计步骤①的目的是_________________________,反应②的化学方程式为_________________(注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______________(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
(4)乙经氢化和氧化得到丙(![]() )。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
)。写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,t2、t3、t4、t5时刻各改变一种条件,且改变的条件均不同。若t4时刻改变的条件是压强,则下列说法错误的是( )
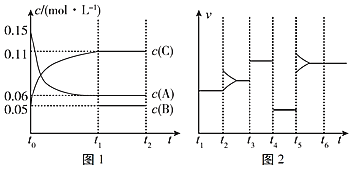
A.若t1=15s,则前15s的平均反应速率υ(C)=0.004molL﹣1s﹣1
B.该反应的化学方程式为3A![]() B+2C
B+2C
C.t2、t3、t5时刻改变的条件可能分别是增大反应物浓度、加入催化剂、升高温度
D.若t1=15s,则B的起始物质的量为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
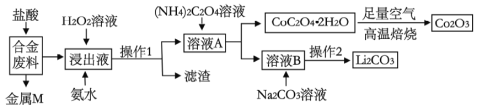
(1)合金废料中加入盐酸浸取,此处盐酸不能换为硝酸,原因是_______________。
(2)操作1用到的玻璃仪器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,应先加入_____________,加入氨水发生反应的离子方程式为____________________。
(4)在空气中焙烧CoC2O4·2H2O的化学方程式是____________________。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
则操作2的具体流程是_______________、_____________、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com