
 (1)下列物质中,①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸,属于强电解质且能导电的是⑤(填序号)
(1)下列物质中,①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸,属于强电解质且能导电的是⑤(填序号)分析 (1)含有自由移动离子或电子的物质能导电,在熔融状态下或水溶液里能导电的化合物是电解质;
(2)在水溶液里只有部分电离的酸是弱酸,依据KW=c(H+)×c(OH-),pH=-lgc(H+)=4求解c(OH-),酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
(3)pH=3的硫酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但一水合氨为弱碱,不完全电离,一水合氨浓度大,反应后剩余一水合氨;
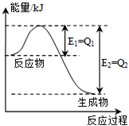
(4)由图求出N2和H2反应生成1molNH3的反应热,再根据热化学反应方程式的书写要求解答.
解答 解:(1)①氯化钠溶液是混合物不是电解质;
②氯化铵固体是电解质,但是不含自由移动的离子或者电子,不导电;
③铜是单质,不是电解质;
④石墨是单质,不是电解质;
⑤熔融NaOH含有自由移动离子能够导电,在熔融状态下或水溶液里能导电的化合物,属于电解质;
⑥稀硫酸是混合物,不是电解质;
⑦乙酸不含不含自由移动的离子或者电子,不导电;
故答案为:⑤;
(2)pH=4溶液中,[H+]=10-4mol/L,0.1mol/L的某酸H2A的pH=4,说明H2A不能完全电离,所以是弱酸;
酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,该溶液中由水电离出的c(H+)=c(OH-)=$\frac{Kw}{[{H}^{+}]}$$\frac{1{0}^{-14}}{10{\;}^{-4}}$=10-10mol/L,
故答案为:弱 10-10mol/L;
(3)pH=3的硫酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但一水合氨为弱碱,不完全电离,一水合氨浓度大,反应后剩余一水合氨
溶液显碱性,所以pH>7;
故答案为:>;
(4)由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(Q1-Q2)kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=2 (Q1-Q2) KJ/mol.
点评 本题为综合题,考查了电解质的判断、弱电解质的电离及pH的有关计算,热化学方程式的书写,题目难度不大,掌握基础是解题关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ⑤ | C. | ④⑤ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.20 | 1.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃保存在带磨口玻璃塞的试剂瓶中 | |
| B. | 少量金属钠可保存在煤油中,大量的金属钠可保存在液体石蜡中 | |
| C. | 氢氟酸保存在磨口试剂瓶中 | |
| D. | 液溴密封盛放在无色试剂瓶中,并在液面上放一层水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(Cl-)+c(OH-) | |
| B. | 由水电离出的c(H+)=1.0×10ˉ 2 mol•Lˉ1 | |
| C. | 与等体积PH=12的氨水混合后所得溶液显中性 | |
| D. | 与等体积0.01 mol•Lˉ1CH3COONa溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与碳酸钠,盐酸与碳酸钙 | |
| B. | 氯化钡与硫酸钠,氢氧化钡与硫酸镁 | |
| C. | 氢氧化钠与盐酸,氢氧化钠与醋酸 | |
| D. | 硝酸钙与碳酸钠,氯化钙与碳酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com