
COCl2的分解反应为COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________mol·L-1;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小_____________________________;
⑤比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小:v(5~6)________v(15~16)(填“<”、“>”或“=”),原因是______________________________。
答案 ①0.234 mol·L-1 ②< ③0.031
④v(5~6)>v(2~3)=v(12~13) ⑤> 在相同温度时,该反应的反应物浓度越高,反应速率越大
解析 ①根据图像得出以下数据:
COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1
开始(mol·L-1) 0.055 0.095 0.07
8 min(mol·L-1) 0.04 0.11 0.085
K=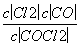 =
=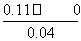 mol·L-1≈0.234 mol·L-1。
mol·L-1≈0.234 mol·L-1。
②2 min和8 min时反应都处于平衡状态,在4 min时生成物浓度都增大,反应物浓度减小,则改变的条件是升高温度,故T(2)<T(8)。
③设12 min时COCl2的平衡浓度为x。
由于12 min时反应在温度T(8)下达到平衡,则由平衡常数定义得
K=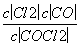 =
= mol·L-1
mol·L-1
=0.234 mol·L-1
解得x≈0.031 mol·L-1。
④分析图像表示的意义,根据图像可得出平均反应速率为v(5~6)>v(2~3)=v(12~13)。
⑤分析图像可知反应在5~6 min和15~16 min时,反应温度相同,因为在相同温度时,该反应的反应物浓度越高,反应速率越大,故v(5~6)>v(15~16)。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO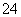 ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO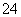 B.CrO
B.CrO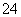 、Br-、Cl-
、Br-、Cl-
C.Br-、Cl-、CrO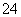 D.Br-、CrO
D.Br-、CrO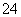 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③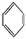 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
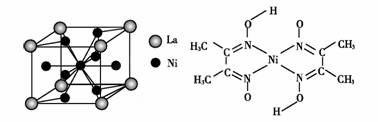
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右上图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 选项 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
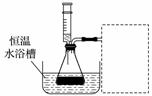
某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2,0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,有反应:mA(g)+nB(g)pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为A减少a mol·L-1,B的平均反应速率v(B)=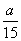 mol·L-1· min-1,C增加
mol·L-1· min-1,C增加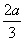 mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2 B.1∶3∶2∶2
C.1∶3∶2∶1 D.1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业上可利用“甲烷蒸气转化法”生产氢气,反应为甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,有关反应的能量变化如图1:
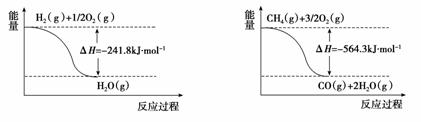
图1
则该反应的热化学方程式_____________________________________。
(2)已知温度、压强对甲烷平衡含量的影响如图2,请回答:
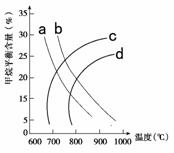
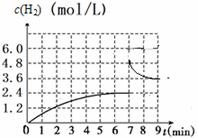
图2 图3
①图26-2中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②该反应的平衡常数:600 ℃时________700 ℃(填“>”“<”或“=”)。
③已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图3),此时CH4的转化率为________________,该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
④从图3分析,由第一次平衡到第二次平衡,平衡移动的方向是_____________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中铵根离子浓度逐渐增大。写出该电池的正极反应式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com