
| A. | 天然气用做燃料 | B. | 无水乙醇直接用作医用消毒 | ||
| C. | 苯酚用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题

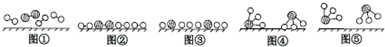
 、
、 、
、 分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂
分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂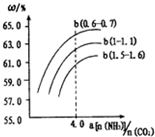
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

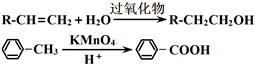

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | HE3中H与E之间以离子键结合 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)5.7 | I2184.0 |
| ③ | (c)19.4 | HCl-84.0 | HBr-67.0 | HI-35.5 |
| ④ | H2O100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、e的化学式分别为Ne、Br2、SnH4 | |
| B. | 系列②物质均有氧化性,系列③物质对应水溶液均是强酸 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>(d)>H2Te | |
| D. | 上表内的物质(c)和H2O,由于氢键的影响,其熔沸点在同族中特别高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com