
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色;iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是______________________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象iii中黄绿色褪去的原因:______________________________
________________________________________________________________________。
解析:本题主要考查SO2与漂粉精反应的实验探究,意在考查考生的信息挖掘能力、实验分析能力和实验探究能力。(1)Cl2和Ca(OH)2制取漂粉精的化学方程式:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。(2)由pH试纸先变蓝后褪色可知,漂粉精溶液具有碱性和漂白性。(3)向水中通入过量SO2不能形成白雾,说明二氧化硫不能形成白雾;用湿润的碘化钾淀粉试纸检验白雾,无变化,说明白雾中不含氯气;根据实验a、b不能判断白雾中含有HCl,因为白雾中混有SO2时也能满足实验a、b的现象,最终生成硫酸银白色沉淀。(4)现象ⅱ中溶液变为黄绿色,说明有氯气生成,即发生反应:Cl-+ClO-+2H+===Cl2↑+H2O,为确认这种可能性,可向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色。(5)①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,说明上层清液中含有SO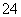 ,则沉淀X中含有CaSO4。
,则沉淀X中含有CaSO4。
答案:(1)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2)碱性、漂白性 (3)①检验白雾中是否含有Cl2,排除Cl2干扰 ②白雾中混有SO2,SO2可与酸化的AgNO3反应生成白色沉淀
(4)向漂粉精溶液中逐滴加入稀硫酸,观察溶液是否变为黄绿色
(5)①CaSO4 ②SO2+Cl2+2H2O===SO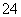 +2Cl-+4H+
+2Cl-+4H+


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是
A.检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,再加盐酸酸化
B.提高KMnO4溶液的氧化能力:用盐酸将KMnO4溶液酸化
C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液
D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法,错误的是( )
A.氮氧化物、二氧化硫都是形成酸雨的主要物质
B.工业合成氨及用NH3制化肥(NH4)2SO4都属于氮的固定
C.一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应
D.玻璃中含有硅酸钠和二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象与对应结论均不正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸发生钝化 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是( )
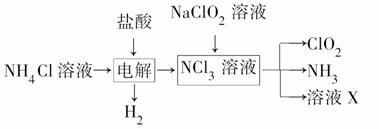
A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑
Cl2↑+H2↑
B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3
C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3
D.溶液X的主要成分为NaCl和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验:
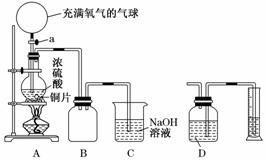
(1)先关闭活塞a,将6.4 g铜片和10 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前___________________________________________________;
打开活塞a之后___________________________________________________。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________________(填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为__________________________________________________;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为________mol(用含a、b的表达式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里鉴定氯酸钾晶体和1氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加入MnO2固体;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用稀HNO3酸化。
(1)鉴定氯酸钾晶体中氯元素的操作步骤是__________(填序号)。
(2)鉴定1氯丙烷中氯元素的操作步骤是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种有机物A、B分子式均为C11H12O5,A或B在稀H2SO4中加热均能生成C和D。
已知:①A、B、C、D能与NaHCO3反应;
②只有A、C能与FeCl3溶液发生显色反应,且核磁共振氢谱显示苯环上有两种不同化学环境的氢原子;
③H能使溴水褪色且不含有甲基;
④F能发生银镜反应。
D能发生如下变化:
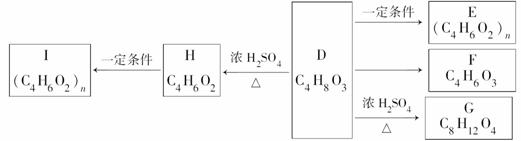 (1)D→H的反应类型: ______________________________;
(1)D→H的反应类型: ______________________________;
D中官能团名称:_________________________________________。
(2)写出C的结构简式:____________________________________。
(3)D→G的化学方程式:_____________________________________。
(4)B在NaOH溶液中受热的化学方程式:______________________
_________________________________________________________。
(5)C的同分异构体有多种,写出同时满足下列三个条件的同分异构体的结构简式:____________________、__________________、____________________ ____。
____。
①苯环上一卤代物只有两种;②能与FeCl3溶液发生显色反应;③能发生银镜反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com