
| A. | 氢气的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
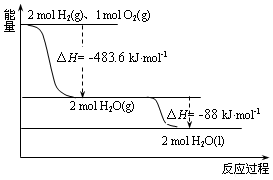
分析 图象分析可知2mol氢气和1mol氧气反应生成气体水2mol放热483.6KJ/mol,方程式:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,2mol气体水变化为2mol液体水放热88KJ/mol,热化学方程式为:2H2O(g)=2H2O(l)△H=-88KJ/mol
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热为量为燃烧热;
B.2 mol H2(g)与1 mol O2(g)生成2 mol H2O(g) 的反应是放热反应;
C.依据2mol氢气和1mol氧气反应生成气体水2mol放热483.6KJ/mol,2mol气体水变化为2mol液体水放热88KJ/mol书写热化学方程式,结合盖斯定律得到液态水分解的热化学方程式分析;
D.H2O(g)生成H2O(l)时,是放热过程.
解答 解:图象分析可知2mol氢气和1mol氧气反应生成气体水2mol放热483.6KJ/mol,方程式:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,2mol气体水变化为2mol液体水放热88KJ/mol,热化学方程式为:2H2O(g)=2H2O(l)△H=-88KJ/mol,
A.①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,
②2H2O(g)=2H2O(l)△H=-88KJ/mol,
盖斯定律计算①+②得到:2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol,燃烧热为285.8KJ/mol,故A错误;
B.图中可知反应为放热反应,2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高,故B错误;
C.依据A的计算得到的热化学方程式2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol,则液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ•mol-1,故C正确;
D.热化学方程式为:2H2O(g)=2H2O(l)△H=-88KJ/mol,H2O(g)生成H2O(l)时,放出热量,变化过程为物理变化,故D错误;
故选C.
点评 本题考查了化学反应能量变化,盖斯定律计算、燃烧热概念,掌握基础是解题关键,题目难度中等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+ | |
| B. | pH=1的溶液:K+、Fe2+、NO3-、Na+ | |
| C. | c(OH-)=1mol•L-1的溶液:AlO2-、CH3COO-、K+、Ba2+ | |
| D. | 遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 锅炉中的水垢中含硫酸钙,可先用碳酸钠溶液处理,再用酸去除 | |
| C. | 实验室可用排饱和食盐水的方法收集氯气 | |
| D. | 钢铁在潮湿的空气中容易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器体积/L c(Y)/(mol•L-1) 温度/℃ | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
| A. | m+n>p | |
| B. | Q<0 | |
| C. | 体积不变,温度升高,平衡向逆反应方向移动 | |
| D. | 温度不变,压强增大,Y的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NaOH)>c(NH3•H2O) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的NaOH与NH3•H2O溶液分别与足量的Si完全反应,NH3•H2O产生的H2多 | |
| D. | 用相同浓度的盐酸溶液分别与等体积的NaOH与NH3•H2O溶液恰好反应完全,NaOH消耗的盐酸溶液体积多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com