
����Ŀ������ʵ������������Լ�ԭ����ȫ��Ӧ����
ʵ����� | ʵ������ | ԭ�� | |
A | �����£���Ũ�Ⱦ�Ϊ0.01mol��L-1��BaCl2��CaCl2�����Һ�еμ�Na2SO4��Һ | ���ְ�ɫ���� | Ksp(BaSO4)< Ksp(CaSO4) |
B | ��ˮ����ͨ�����ȵ����� | ���۱�Ϊ��ɫ | ��������ˮ�ڸ����·�����Ӧ |
C | �����ˮ��IJ����м������Ƶ�������Һ | û�г����������� | ���������Ƶ�������Һ�����˷�Ӧ |
D | ��ͬ�¶��£�����ͬ��С�ƿ�ֱ�ӵ�ˮ�����ᡢ�Ҵ��� | �������������ʣ�����>ˮ>�Ҵ� | ���ֵ���ʵ���H+����������>ˮ>�Ҵ� |
A. A B. B C. C D. D
���𰸡�C
��������A�BaCl2��CaCl2��Һ�м���Na2SO4��Һ���ܲ�����ɫ��������Ũ�Ⱦ�Ϊ0.01mol/L��BaCl2��CaCl2�����Һ�еμ�Na2SO4��Һ�����ְ�ɫ����������˵��SO42-����Ba2+��Ӧ��������Ca2+��Ӧ��A�����B�����ˮ���������·�Ӧ���ɺ�ɫ��Fe3O4�����H2����Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O��g��![]() Fe3O4+4H2��B�����C�����ˮ��ʱ����H2SO4��������������Һ�ʼ��ԣ������ˮ��IJ����м������Ƶ�������Һ��û�г���������˵������H2SO4��������Һ�����˷�Ӧ��C����ȷ��D���ͬ�¶��½���ͬ��С�ƿ�ֱ�ӵ�ˮ�����ᡢ�Ҵ��У�����H2�����ʣ�����
Fe3O4+4H2��B�����C�����ˮ��ʱ����H2SO4��������������Һ�ʼ��ԣ������ˮ��IJ����м������Ƶ�������Һ��û�г���������˵������H2SO4��������Һ�����˷�Ӧ��C����ȷ��D���ͬ�¶��½���ͬ��С�ƿ�ֱ�ӵ�ˮ�����ᡢ�Ҵ��У�����H2�����ʣ�����![]() ˮ
ˮ![]() �Ҵ���˵���ǻ���Ļ��ԣ�����
�Ҵ���˵���ǻ���Ļ��ԣ�����![]() ˮ
ˮ![]() �Ҵ����Ҵ����ڷǵ���ʣ��Ҵ���������H+��D�����ѡC��
�Ҵ����Ҵ����ڷǵ���ʣ��Ҵ���������H+��D�����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���ˮ�е��ܽ�Ƚ�С�����ܽ������ʵ�������Ƶ�ˮʱ���������ⵥ�ʼ���ϡKI��Һ�С�����Һ�д���ƽ�⣺ ![]() ���÷�Ӧ��ƽ�ⳣ��K���¶ȱ仯������ͼ��ʾ������˵���У���ȷ����
���÷�Ӧ��ƽ�ⳣ��K���¶ȱ仯������ͼ��ʾ������˵���У���ȷ����

A. ��������ϵ�м���CCl4��ƽ�ⲻ�ƶ�
B. 25 Cʱ����������ϵ�м�������I2��ƽ�������ƶ���ƽ�ⳣ������680
C. �÷�Ӧ��ƽ�ⳣ������ʽΪ
D. �÷�Ӧ������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֿ�����ʹ�õ�﮵�ؽṹ��ͼ��ʾ�������йظõ�طŵ�ʱ��˵����ȷ����

A. ������Li�缫��Li+��Ĥ����Fe2+��Fe3+��ˮ��Һ����Ti�缫
B. Ti�缫�Ϸ����ĵ缫��ӦΪ��Fe3+ + e- �� Fe2+
C. Li+��Ĥ������Li+ͨ����,������H2O����ͨ��
D. �����з��������ӷ�ӦΪ��S2O82- + 2Fe3+ �� 2Fe2+ + 2SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��ֻ��ͨ����ԭ��Ӧ����ʵ�ֵ��ǣ� ��
A. Fe3+��Fe2+B.Mn2+��MnO4��C.Cl����Cl2D.N2O3��HNO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����Ŀ��
��12.0g���ڵ�NaHSO4�к��е���������Ϊ0.2NA
��1mol Na2O ��Na2O2�����������������������3NA
�۳��³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
��7.8g![]() �к��е�̼̼˫����ĿΪ0.3NA
�к��е�̼̼˫����ĿΪ0.3NA
����1L1.0 mol/LFeCl3��Һ�Ʊ������������壬��������������������ĿΪNA
��1mol SO2������O2��һ�������³�ַ�Ӧ����SO3����ת��2NA������
���ڷ�ӦKIO3+6HI=KI+3I2 +3H2O �У�ÿ����3molI2ת�Ƶĵ�����Ϊ5NA
�ೣ�³�ѹ�£�17 g��(��14CH3)��������������Ϊ9NA
A. 3 B. 4 C. 5 D. 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��װ������ͼ��ʾ�ĵ绯ѧװ�ã��缫��Ϊ Zn���缫��ΪCu�������缫��Ϊʯī��������˵����ȷ����
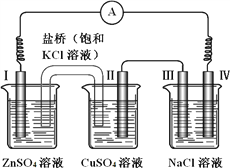
A. �����������缫�� �� �� �� �缫��
B. �����е�K��������ZnSO4��Һ
C. III���õ�����2.24L���缫II������6.4g����
D. NaCl��Һ�У��缫���Ƶ��������缫���Ƶý�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol��L-1NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.10 mol��L-1��CH3COOH ��Һ��HCN��Һ���õζ�������ͼ��ʾ������˵����ȷ����
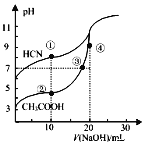
A. ������10mLNaOHʱ��c(CH3COOH)>c(HCN)
B. ��ۺ͵����ʾ��Һ�У�c(Na+)��c(OH-)��c(CH3COO-)��c(H+)
C. ��֪������ij��AOH��Kb=1��10-9����ACN��ˮ��Һ�ʼ���
D. ��ں͵����ʾ��Һ�ж��У�c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��һֱ�����ڶԻ�ѧ��Ӧ���еķ����Ⱥ����ʽ����о���Ѱ�Һ������۶�����н��͡�
I.Ϊ����������β����Ⱦ������NO��CO������ȣ�����ѧ�������������������װ�ϴ����������·�Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��ij�¶��£������Ϊ1L���ܱ������г���NO��CO��0.1mol��ƽ��ʱNO��ת����Ϊ60%������÷�Ӧ��ƽ�ⳣ��K=______________���˷�Ӧ�������ܹ��Է����е�ԭ����_______________________��
N2(g)+2CO2(g)��ij�¶��£������Ϊ1L���ܱ������г���NO��CO��0.1mol��ƽ��ʱNO��ת����Ϊ60%������÷�Ӧ��ƽ�ⳣ��K=______________���˷�Ӧ�������ܹ��Է����е�ԭ����_______________________��
��.��ͼ�Ǹ������������Һ����ᷢ����Ӧ���й�ͼ����Һ���Ϊ500mL��
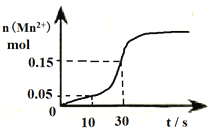
��1���÷�Ӧ��10-30s�Ļ�ѧ��Ӧ����v(Mn2+)=________________________��
��2����д���÷�Ӧ�����ӷ���ʽ____________________________________________________��
��3���۲�ͼ��˵����һ���¶��·�Ӧ������ʼ����Ȼ��ӿ��ԭ��______________________��
��. ���ܵ����FeS��ˮ��Һ�д������ܽ�ƽ����FeS(s)![]() Fe2+(aq) + S2��(aq),��һ���¶��£�Ksp=c(Fe2+)��c(S2��)=6.25��10-18���ڸ��¶��£������ᱥ����Һ�д���c2(H+)�� c(S2��)=1.0��10-22��������FeCl2Ͷ�������ᱥ����Һ�У���ʹ��Һ��c(Fe2+)=1.0 mol��L��1��Ӧ������Һ��c(H+)=_______��
Fe2+(aq) + S2��(aq),��һ���¶��£�Ksp=c(Fe2+)��c(S2��)=6.25��10-18���ڸ��¶��£������ᱥ����Һ�д���c2(H+)�� c(S2��)=1.0��10-22��������FeCl2Ͷ�������ᱥ����Һ�У���ʹ��Һ��c(Fe2+)=1.0 mol��L��1��Ӧ������Һ��c(H+)=_______��
IV.��������H2S�Ƿֲ�����ģ�H2S![]() H+ + HS�� K1=1.3��10-7��HS-
H+ + HS�� K1=1.3��10-7��HS-![]() H+ + S2�� K2=7.1��10-15��ʹ��Һ��c(S2��)Ũ������Ӧ��ȡ�Ĵ�ʩ��_____________��
H+ + S2�� K2=7.1��10-15��ʹ��Һ��c(S2��)Ũ������Ӧ��ȡ�Ĵ�ʩ��_____________��
A������NaOH B������CuSO4 C���ʵ������¶� D��ͨ�����SO2 E������Na2CO3 (H2CO3���볣��K1=4.4��10-7��K2=4.7��10-11)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com