
����Ŀ����ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2(g)��O2(g)��Ӧ����NO(g)�����е������仯������˵����ȷ����( )
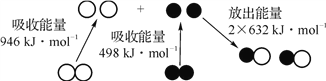
A. �ŵ������£�N2(g)��O2(g)�����ֱ�ӻ�������NO(g)
B. NO��һ���������������NaOH��Һ������NO��β��
C. N2(g)��O2(g)��Ӧ���� NO(g)���൱��N2(g)��O2(g)ȼ�գ��÷�Ӧ����
D. 28 g N2(g)��32 g O2(g)��ȫ��Ӧ���� NO(g)���ų�������Ϊ180 kJ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺ 
��1��д���ٺ͢�����Ԫ��ԭ�Ӱ�1��1��ɵij���������ĵ���ʽ
��2���õ���ʽ��ʾ�͢��γɻ�����Ĺ��̣�
��3���ۡ��ࡢ�������������Ӧˮ�����������ǿ������˳��Ϊ���û�ѧʽ��ʾ����
��4����֪���ڱ��д��ڶԽ����ƹ��������������ڱ��д��ڶԽ���λ����ѧ�������ƣ��ڵ��������������Ҳ�����ԣ�д���ڵ�������������������ﷴӦ�Ļ�ѧ����ʽ ��
��5���ݡ��ޡ�������Ӱ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S ��SO2 ��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ�����������Щ�к�������ŷš�
I.H2S �ij�ȥ
����1: ������H2S����Ӧ��ԭ��ΪH2S + Fe2(SO4)3==S��+2FeSO4+H2SO4��4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O��
2Fe2(SO4)3 +2H2O��
��1����˾�����ʱ��FeSO4����������������ʱ��5��105 �����þ���������______��
��2����ͼ1��ͼ2 �жϣ�ʹ����˾����������Ϊ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����______________��


����2: ��һ�������£���H2O2 ����H2S
��3�����Ųμӷ�Ӧ��n(H2O2)/n(H2S) �仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ���������� �ķ���ʽΪ________��
II.SO2 �ij�ȥ
����1( ˫�): ��NaOH ����SO2 ������CaO ʹNaOH ����:NaOH ��Һ![]() Na2SO3
Na2SO3
��4��д�������������ӷ���ʽ:_________________��
��5��CaO ��ˮ�д�������ת��:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)����ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ��:_______________��
Ca2+(aq) +2OH- (aq)����ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ��:_______________��
����2:�ð�ˮ��ȥSO2
��6����֪25����NH3��H2O��Kb=1.8��10-5��H2SO3��Ka1=1.3��10-2��Ka2=6.2��10-8������ˮ��Ũ��Ϊ2.0mol/L����Һ�е�c(OH-)=________����SO2 ͨ��ð�ˮ�У���c(OH-)����1.0��10-7mol/Lʱ����Һ�е�c (SO32-)/c(HSO3-) =_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƴ�������Ⱦ�Ϻ��л��ϳɹ�ҵ����ľм�Ʊ��������Ƶ���������:

��֪:�����������У����Ʒ�ӦҺ���¶���55��60�棬��������Ҫ��ӦΪC6H12O6+12HNO3![]() 3H2C2O4+9NO2��+3NO��+9H2O��
3H2C2O4+9NO2��+3NO��+9H2O��
��NaNO2�������ԣ��������������ܰ�I-����ΪI2��S2O32-�ܰ�I2��ԭΪI-
��NaNO2Ҳ�л�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ
��1�����ܹ�����,��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ______________��
��2��ʵ����ģ�����������չ��̵�װ��(���Ⱥ������̶��b������ȥ)����ͼ��ʾ

��ʵ��װ��ͼ������a������Ϊ______________��
��Aװ������Ʒ�ӦҺ���¶Ȳ�����60���ԭ����_____________��
��Bװ�������Ʊ��������ƣ�����ʢ�ŵ���Һ��__________(����ĸ)��
a.NaCl��Һ b.Na2CO3��Һ c.NaNO3��Һ
��3����ҵ�������չ����������NO��NO2�����ʵ����Ƚӽ�1:1����n(NO):n(NO2)>l:1����ᵼ��________����n(NO)��n(NO2)<1:1����ᵼ��________��
��4��Ϊ�ⶨ��ƷNaNO2�Ĵ��ȣ��벹������ʵ�鷽����ȷ����������NaNO2��Ʒ������ƿ�У�������ˮ�ܽ⣬________��(ʵ���пɹ�ѡ����Լ���ϡ���ᡢ������Һ����̪��Һ��c1mol/LKI��Һ��c2mol/LNa2S2O3��Һ��c3mol/L����KMnO4��Һ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K+��NH4+��Cl����Mg2+��
Ba2+��CO32����SO42�� �� ��ȡ����100mL��Һ��������ʵ�飺
�ٵ�һ�ݼ���AgNO3��Һ�г�������
�ڵڶ��ݼ�����NaOH��Һ���Ⱥ��ռ�������0.04mol
�۵����ݼ�����BaCl2��Һ�ø������6.27g������������ϴ�ӡ������������Ϊ2.33g��
�Իش���������
��1����ʵ��ڿ�֪��Һ�к��е�����Ϊ �� ��100mL��Һ�и����ӵ����ʵ���Ũ��Ϊ
��2����ʵ��ۿ����ж�����Һ�к��е�����Ϊ
��3��������ʵ����Ϣ�ж�����˵������ȷ������
A.K+һ������
B.100mL��Һ�к�0.01mol CO32��
C.Cl�����ܴ���
D.Ba2+һ�������ڣ�Mg2+���ܴ��ڣ�
��4����������ʵ�飬����Һ���Ƿ��в��ܿ϶�����ڵ����ӣ����У���Ϊ��һ��ȷ������ڣ�Ӧ�ò����ʵ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����Ŀ�� 
��1������ͼ1��ʾ��������д����������D ��
��2��ijͬѧ��������ƽ�����ձ�����������ƽƽ����״̬��ͼ2����ͼ�п��Կ�������ͬѧ�ڲ���ʱ��һ�������� �� �ձ���ʵ������Ϊg��
��3��ͼ3��ʾ10mL��Ͳ��Һ���λ�ã�A��B��B��C�̶ȼ����1mL������̶�AΪ8����Ͳ��Һ��������mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽĿ�ĵ���
ѡ�� | Ŀ �� | ʵ �� |
A | �ӿ�ϡ��Һ�в�����KMnO4�ķ�Ӧ | ����Һ�м�������MnSO4���� |
B | ���麣���еĵ�Ԫ�� | ���ҽ�ȡҺ�еμӵ�����Һ |
C | ��ȥʳ��ˮ�е�����BaCl2 | ��ʳ��ˮ��ͨ�������CO2 |
D | �Ʊ��������� | ����������������ƹ����ϼ��� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼���ij��Һ���Ƿ��г��������������ӣ�ij��ѧС���ͬѧ������������ʾ��ʵ����������м�������в�����������ʹʪ��ĺ�ɫʯ����ֽ�������ɸ�ʵ���ܵó�����ȷ�����ǣ� ��

A��ԭ��Һ��һ������SO42- B��ԭ��Һ��һ������NH4+
C��ԭ��Һ��һ������Cl- D��ԭ��Һ��һ������Fe3+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com