
 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. .
.分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(2)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;Fe(CO)5分子中含5个配位键,配体CO内含有1个碳氧三键;
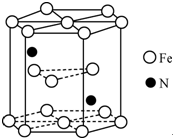
②观察晶胞,确定各原子数目和所在位置,利用均摊法计算该化合物化学式;
(3)①氧与硫的最外层电子数相同,根据题目信息,确定SCN-中各原子的连接顺序以及成键方式,再结合离子电子式的方法得出答案;
②FeCl3与苯酚反应生成[Fe(OC6H5)6]3-和氯化氢;
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)①氮原子含有3个共价键和一个孤电子对,N原子轨道的杂化类型是sp3,Fe(CO)5分子中含5个配位键,配体CO内含有1个碳氧三键,所以1molFe(CO)5分子中含有的σ键的数目10 mol,故答案为:sp3;10 mol;
②N原子位于体内,数目为2;
Fe原子位于顶点、面心和体内,数目为12×$\frac{1}{6}$+2×$\frac{1}{2}$+3=6;
即化学式可写为:Fe3N,故答案为:Fe3N;
(3)①因氧与硫的最外层电子数相同,根据题目信息,确定SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式 ,故答案为:
,故答案为: ;
;
②FeCl3与苯酚反应生成[Fe(OC6H5)6]3-和氯化氢,所以方程式为FeCl3+6C6H5OH→H3[Fe(OC6H5)6]+3HCl,
故答案为:FeCl3+6C6H5OH→H3[Fe(OC6H5)6]+3HCl.
点评 本题考查较综合,涉及电子排布式的书写、杂化方式的判断、晶胞的计算等知识点,难点是配位数的计算,同时考查学生空间想象能力,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
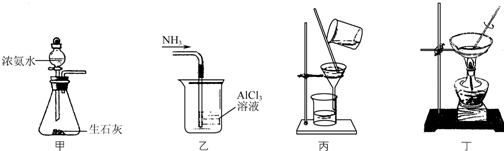
| A. | 用装置甲制取NH3 | |
| B. | 用装置乙吸收NH3制取Al(OH)3 | |
| C. | 用装置丙在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| D. | 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1CH3COOH与0.1 mol•L-1氨水等体积混合(pH=7): c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1 mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7): c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CaCl2溶液等体积混合: c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合: c(HCO3-)>0.05 mol•L-1>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,2,3三甲基苯 | B. | 丁烷 | C. | 异丙醇 | D. | 醋酸叔丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com