
分析 (1)(a)分别计算出两溶液中氯化钠的质量、溶液的质量,然后结合质量分数的表达式计算;
(b)根据物质的量浓度c=$\frac{1000ρω}{M}$计算出混合液中氯化钠的浓度;
(c)设需要溶解氯化钠的物质的量为x,根据溶质质量分数为20%列式计算;
(2)(a)由方程式可知,反应前后气体的体积不发生变化,据此计算氧气的体积;
(b)标准状况下,气体摩尔质量M=Vm×ρ,据此计算气体X2的摩尔质量;根据方程式计算的物质的量X2Y4,再计算X2Y4的相对分子质量,进而计算Y的相对原子质量,确定Y元素名称.
解答 解:(1)(a)常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,则混合液中溶质氯化钠的质量分数为:$\frac{20.0g×14.0%+30.0g×24.0%}{20.0g+30.0g}$×100%=20%,
故答案为:20%;
(b)混合液的密度为1.17g/cm-3,质量分数为20%,则混合液的浓度为:c=$\frac{1000×1.17×20%}{58.5}$mol/L=4mol/L,
故答案为:4moL/L;
(c)设在1000g水中溶解x molNaCl才能使其浓度与上述混合溶液的浓度相等,根据混合液的质量分数为20%可得:$\frac{58.5x}{1000+58.5x}$×100%=20%,解得:x≈4.3mol,
故答案为:4.3;
(2)(a)由方程式可知,反应前后气体的体积不发生变化,X2和氧气的关系式为1:1,故V(O2)=V(X2)=11.2L,
故答案为:11.2L;
(b)标准状况下,气体摩尔质量M=Vm×ρ,气体X2的摩尔质量=22.4L/mol×1.25g/L=28 g•mol-1,
11.2L X2的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,n(X2Y4)=n(X2)=0.5mol,故Mr(X2Y4)=$\frac{16}{0.5}$=32,则Y的相对原子质量=$\frac{32-28}{4}$=1,
故Y为氢元素,
故答案为:28 g•mol-1;氢元素.
点评 本题考查物质的量浓度、物质的量的计算,题目难度中等,注意熟练掌握物质的量与物质的量浓度、摩尔质量、气体摩尔体积等之间关系,明确气体的摩尔质量与密度的关系.


科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 | |
| C. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| D. | 1molNa2O2固体中含离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 1 mol•L-1 NaNO3 溶液 | B. | 10 mL 1 mol•L-1Al(NO3)3 溶液 | ||
| C. | 15 mL 2 mol•L-1 AgNO3 溶液 | D. | 10 mL 1.5 mol•L-1Cu(NO3)2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: ,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:
,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
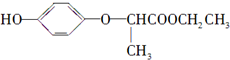 下列有关HPE的说法正确的是( )
下列有关HPE的说法正确的是( )| A. | 1 mol HPE最多可和2 mol NaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | HPE不能发生加成反应 | |
| D. | HPE在核磁共振氢谱中有6个峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com