
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
科目:高中化学 来源: 题型:推断题
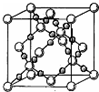 X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.
X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.60 g | B. | 2.76 g | C. | 4.36 g | D. | 5.54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
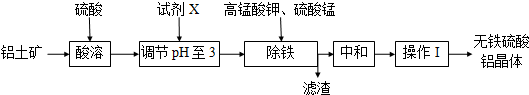
| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.4×10-7 |
| Ki2=4.7×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO-<HCO3-<F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上式中缺项所填物质在反应中作氧化剂 | |
| B. | 在RO3-参与的氧化还原反应中,R元素只能被还原 | |
| C. | 上述反应中,转移电子数为5NA | |
| D. | 同周期主族元素原子中R的原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
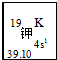 我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题: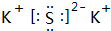 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 金 属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1 487 |
| 镧 | 920 | 3 470 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

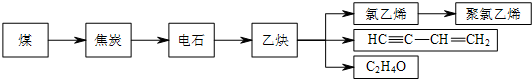
 ,随意丢弃聚氯乙烯制品会造成白色污染.
,随意丢弃聚氯乙烯制品会造成白色污染.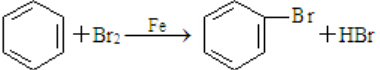 ,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).
,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com