
【题目】高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下:
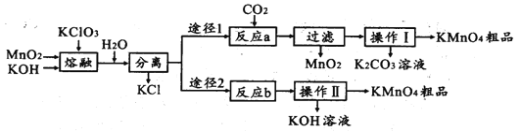
(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择____________________________
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:______________________________________
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在____________ (填性质)上的差异,采用浓缩结晶、趁热过滤得到KMnO4。趁热过滤的原因是______________________________________
(4)反应b是电解法制备KMnO4,其装置如图所示,a作____________极(填“阳”或“阴”),中间的离子交换膜是_____ (填“阳”或“阴”)离子交换膜。阳极的电极反应式为____________
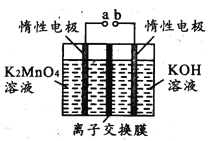
(5)取反应b后的电解液,加硫酸溶解后,用0.1000mol ·L-1FeSO4标准溶液滴定至终点时,消耗250.0mL标准溶液,则电解后溶液中的KMnO4的质量是_________g。
(6)两种途径的制备方法,途径1与途径2理论产率之比为_________
(7)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填标号)。
a.双氧水 b.84消液(NaClO溶液) c.75%酒精 d.苯酚
【答案】D 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O 溶解性 避免温度下降,造成主产品的纯度降低 阳 阳 MnO42--e-==MnO4- 0.79 2:3 ab
3K2MnO4+KCl+3H2O 溶解性 避免温度下降,造成主产品的纯度降低 阳 阳 MnO42--e-==MnO4- 0.79 2:3 ab
【解析】
在工业流程中,原料中的MnO2、KOH、KClO3发生如下反应:
3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
在途径1中发生反应为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3,
在途径2中发生反应为:2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑。
2KMnO4+2KOH+H2↑。
(1)因为KOH能与SiO2反应,所以实验室熔融二氧化锰、氧氧化钾、氯酸钾时,应选择不含SiO2成分的坩埚,只能选择铁坩埚,答案为D;
(2)由前面分析知,第一步熔融时生成K2MnO4的化学方程式为:
3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,
3K2MnO4+KCl+3H2O,
答案为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
(3) 采用浓缩结晶、趁热过滤方法得到KMnO4,应利用两者的溶解性差异;趁热过滤的原因是防止过滤过程中因温度降低导致K2CO3结晶析出。答案为:溶解性;避免温度下降,造成主产品的纯度降低;
(4) 反应b是电解法制备KMnO4,在a电极上,K2MnO4失电子转化为KMnO4,所以a电极应为阳极;转化后多出的K+将通过交换膜进入阴极,所以交换膜应为阳离子交换膜;阳极的电极反应式为MnO42--e-=MnO4-,答案为阳极;阳离子交换膜;MnO42--e-=MnO4-;
(5) 利用得失电子守恒,可建立如下关系式:
KMnO4——5FeSO4
1mol 5mol
0.005mol 0.025mol
m(KMnO4)= 0.005mol×158g/mol=0.79g,答案为0.79;
(6)在途径1中发生反应为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3,K2MnO4转化率为2/3,在途径2中发生反应为:2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑,K2MnO4转化率为1,途径1与途径2理论产率之比为2/3 : 1=2 : 3,答案为2 : 3;
2KMnO4+2KOH+H2↑,K2MnO4转化率为1,途径1与途径2理论产率之比为2/3 : 1=2 : 3,答案为2 : 3;
(7) KMnO4稀溶液作消毒剂时,表现出强氧化性,其消毒原理与双氧水、84消液(NaClO溶液)相同,答案为ab。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如图:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。电解时生成的气体B是___:电解时阳极反应式为__。反应Ⅲ的化学方程式为___。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+ I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
①准确量取10.00mLClO2溶液的玻璃仪器是__。
②上述步骤3中滴定终点的现象是___。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果__(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为__mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
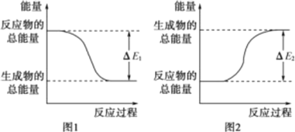
A.铵盐和碱混合即可反应,其能量变化符合图 1
B.0.1mol H2SO4 溶液和 0.1mol Ba(OH)2 溶液的反应符合图 2,且吸收热量为ΔE2
C.0.1mol HCl 溶液和 0.1mol NaOH 溶液的反应符合图 1,且放出热量为ΔE1
D.发生图 1 能量变化的任何反应,一定不需要加热即可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
H2O(g)=H2O(l) ΔH=c kJ·mol1
(1)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =______kJ·mol1
(2)H2(g)+1/2O2(g)=1/2H2O(l)的过程如下图所示,H-O键的键能是______kJ·mol1。

(3)某化学兴趣小组用甲醇燃料电池来模拟铝制品表面“钝化”处理过程(装置如图甲所示)。a电极发生的电极反应方程式为______。实验结束后若硫酸溶液质量减少1.08 g,则石墨电极处生成的气体在标准状况下的体积为______L。

(4)一种Na-CO2二次电池装置如图乙所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。充电时的阳极反应式为______。
2Na2CO3+C。充电时的阳极反应式为______。
(5)海水中含有大量的HCO3-,一种利用海水提取CO2的装置如图丙所示。结合方程式简述提取CO2的原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,B的基态原子2p轨道上未成对电子数是C的3倍;D的基态原子含13种运动状态不同的电子;E与A位于同一主族;F2+的3d轨道中有9个电子。(答题时用字母对应的元素符号表示)
⑴元素A、B、C的电负性由大到小的顺序为______。
⑵F的基态原子价层电子排布式为______。
⑶BC3的空间构型为______,与BC3互为等电子体的一种阴离子的化学式为______。
⑷一种化合物X的晶体结构如图,X的化学式为______。 (图中○:E+,●:DC![]() )
)
⑸化合物AC与EC中熔点更高的是_________,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
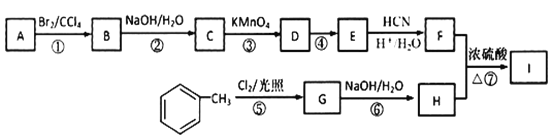
已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸气密度是相同条件下H2的28倍;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
②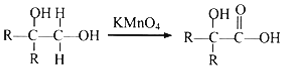 其中R为烃基。
其中R为烃基。
③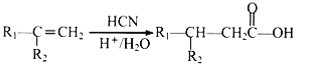 其中R1和R2均为烃基。
其中R1和R2均为烃基。
回答下列问题:
(1)A的结构简式为___________________。
(2)D中官能团的名称是______________________。
(3)反应②的化学方程式为______________。
(4)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是__________(填序号)。
(6)反应⑦的化学方程式为_________________。
(7)参照上述合成路线,以 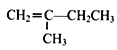 为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料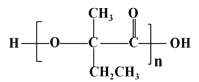 _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是
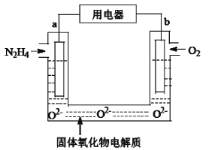
A.b极是正极,发生还原反应
B.电池电路中,电流方向:电极a→用电器→电极b
C.当电极a.上消耗1 mol N2H4时,电极b上被氧化的O2在标准状况下体积为11.2 L
D.b极附近的pH值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子式为C3H6O2的二元混合物,如果在核磁共振氢谱上观察到氢原子给出的峰有两种情况.第一种情况峰给出的强度为1:1;第二种情况峰给出的强度为3:2:1。由此推断混合物的组成可能是_______(写结构简式,写一种组合即可)。如图是一种分子式为C3H6O2的有机物的红外光谱图,则该有机物的结构简式为______。

(2)经测定,某有机物含碳77.8%、氢7.4%、氧14.8%;用质谱仪测定结果如下图。分析求此有机物的分子式为______。若此有机物能与烧碱反应,且苯环上的一溴代物只有四种,试写出它的结构简式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.是一种重要的有机合成中间体,由芳香烃A和E为有机原料和其他必要试剂制备Ⅰ的合成路线如图:

已知:Ⅰ.RX![]() RCOOH;
RCOOH;
Ⅱ.R—CH=CH2![]() R—CH2CH2Br;
R—CH2CH2Br;
Ⅲ.![]() 。
。
请回答下列问题:
(1)A的分子式为___。Ⅰ中含有官能团的名称为_____。
(2)C→D、H→I的反应类型分别为____、____。
(3)E的化学名称为______,一定条件下,E发生加聚反应的化学方程式为____。
(4)F→G的化学方程式为____。
(5)H的结构简式为____。
(6)同时满足下列条件的C的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为____。
①能与FeCl3溶液发生显色反应
②能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com