
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
| A、CH3OH的起始浓度为1.64 mol/L |
| B、此时逆反应速率小于正反应速率 |
| C、平衡时,CH3OH的浓度为0.04 mol/L |
| D、平衡时,CH3OH的转化率小于90% |
| 0.6×0.6 |
| 0.442 |
| (0.5x)2 |
| (1.64-x)2 |
| 1.6mol/L |
| 1.64mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.
实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
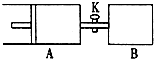 如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )
如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )| A、反应速率:V(B)<V(A) |
| B、A容器中X转化率为20% |
| C、平衡时的压强:P(B)=2P(A) |
| D、若打开K,则达到新的化学平衡时,A的体积为2.6aL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的平均反应速率为0.15mol/(L?min) |
| B、恒温达到平衡时容器内压强为开始时的85% |
| C、B的转化率为10% |
| D、平衡时A的浓度为0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
 ;△H1
;△H1查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| B、乙烷在1H核磁共振谱中只会在一个位置上出现特征峰 |
| C、红外光谱能够快速、微量、精确的测定相对分子质量 |
| D、“基团理论”认为有机化学中的“基”是一成不变的,这种说法是不正确的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com