【答案】
分析:A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,F元素的最外层电子数是次外层电子数的0.75倍,则次外层电子为8,最外层电子数为6,则F为S元素;由B元素的最外层电子数是内层电子数的2倍,内层电子数为2,则最外层电子数为4,所以B为C元素;E元素的最外层电子数等于其电子层数,则为第三周期第ⅢA族,即E为Al;C、F是同一主族元素,则C为O元素;A、D是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,则A、D的质子数相差10,即A为H,D为Na,
即A为H,B为C,C为O,D为Na,E为Al,F为S.
(1)根据发生的化学反应来分析量的关系;
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,为HS
-,乙有10个电子,为OH
-;
(3)由燃烧热的热方程式及盖斯定律来分析;
(4)由pV=nRT及外界条件对平衡的影响来分析;
(5)根据发生的反应及化合价变化来分析.
解答:解:A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,F元素的最外层电子数是次外层电子数的0.75倍,则次外层电子为8,最外层电子数为6,则F为S元素;由B元素的最外层电子数是内层电子数的2倍,内层电子数为2,则最外层电子数为4,所以B为C元素;E元素的最外层电子数等于其电子层数,则为第三周期第ⅢA族,即E为Al;C、F是同一主族元素,则C为O元素;A、D是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,则A、D的质子数相差10,即A为H,D为Na,
即A为H,B为C,C为O,D为Na,E为Al,F为S.
(1)1molAl
2S
3与A、C、D三种元素组成的化合物NaOH溶液反应,先和水反应生成2molAl(OH)
3、3molH
2S,
由Al(OH)
3+OH
-=AlO
2-+2H
2O,H
2S+2NaOH=Na
2S+2H
2O,
则消耗NaOH的物质的量为8mol,故答案为:8mol;
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,为HS
-,乙有10个电子,为OH
-,二者反应的离子反应为HS
-+OH
-=S
2-+H
2O,
故答案为:HS
-+OH
-=S
2-+H
2O;
(3)单质B的燃烧热akJ/mol,则C(s)+O
2(g)=CO
2(g);△H=-akJ/mol①,
BC14g完全燃烧放出bkJ热量,则CO(g)+

O
2(g)=CO
2(g);△H=-2bkJ/mol①,
由盖斯定律可知,①-②可得C(s)+

O
2(g)=CO(g);△H=-(a-2b)kJ/mol,
故答案为:C(s)+

O
2(g)=CO(g);△H=-(a-2b)kJ/mol;
(4)在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA
2C和1molBC、2molA
2C和2molBC,则Ⅱ中n大,p大,
A.Ⅱ中压强大,反应速率快,时间少,则达到平衡所需要的时间:Ⅰ>Ⅱ,故A正确;
B.Ⅰ和Ⅱ中物质的量成正比,为等效平衡,则平衡达到平衡后A
2C的转化率:Ⅰ=Ⅱ,故B正确;
C.Ⅱ中压强大,平衡正向移动,则达到平衡后BC的物质的量:Ⅰ<Ⅱ,故C错误;
D.Ⅰ和Ⅱ中物质的量成正比,为等效平衡,达到平衡后A
2的体积分数:Ⅰ=Ⅱ,故D错误;
E.由物质的量与热量成正比,Ⅱ中物质的量大,则放热多,则达到平衡后吸收或放出的热量:Ⅰ<Ⅱ,故E错误;
F.由M=
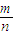
可知,Ⅱ中的质量与物质的量均为Ⅰ中的2倍,则M相同,达到平衡后体系的平均相对分子质量:Ⅰ=Ⅱ,故F错误;
故答案为:AB;
(5)B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,发生2Al+2NaOH+2H
2O═2NaAlO
2+3H
2↑,
Al失去电子,化合价升高,则Al为负极,电极反应为Al-3e
-+4OH
-=AlO
2-+2H
2O,故答案为:Al-3e
-+4OH
-=AlO
2-+2H
2O.
点评:本题考查位置、结构、性质的关系及应用,综合性较强,考查知识点较多,元素的推断是解答本题的关键,并熟悉元素化合物的性质来解答,难度较大.

 O2(g)=CO2(g);△H=-2bkJ/mol①,
O2(g)=CO2(g);△H=-2bkJ/mol①, O2(g)=CO(g);△H=-(a-2b)kJ/mol,
O2(g)=CO(g);△H=-(a-2b)kJ/mol, O2(g)=CO(g);△H=-(a-2b)kJ/mol;
O2(g)=CO(g);△H=-(a-2b)kJ/mol;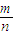 可知,Ⅱ中的质量与物质的量均为Ⅰ中的2倍,则M相同,达到平衡后体系的平均相对分子质量:Ⅰ=Ⅱ,故F错误;
可知,Ⅱ中的质量与物质的量均为Ⅰ中的2倍,则M相同,达到平衡后体系的平均相对分子质量:Ⅰ=Ⅱ,故F错误;

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.