
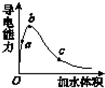
 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.
在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大;导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)要使醋酸根离子浓度增大,可以采用加热、加入含有醋酸根离子的物质、加入和氢离子反应的物质;
(4)电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$进行计算;
(5)加水稀释,促进电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此解答.
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸为共价化合物,不存在离子键,则没有自由移动的离子,所以冰醋酸不导电,
故答案为:不含;
(2)醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大,根据图象知,水的体积越大,溶液的浓度越小,醋酸的电离程度越大,所以醋酸电离程度大小顺序是c>b>a;
溶液的导电能力与离子浓度成正比,所以溶液导电能力越大氢离子浓度越大,则氢离子浓度最大的为b,
故答案为:c>b>a;b;
(3)要使醋酸根离子浓度增大,c(H+)减少,可以采用消耗氢离子的方法使电离平衡向正方向移动,故可以加入Zn,NaOH等;或者增加醋酸根浓度使电离向逆方向移动,故可加CH3COONa等,
故答案为:加入Zn,NaOH或CH3COONa;
(4)经实验测得C点处:c(CH3COOH)=0.1mol•L-1,c(CH3COO-)=0.001mol•L-1,则该条件下CH3COOH的电离常数Ka=$\frac{0.001molL×0.001mol/L}{0.1mol/L}$=1.0×10-5,
故答案为:1.0×10-5;
(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;
B.弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;
C.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;
D.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则c(H+)/c(CH3COOH)增大,故D正确;
故答案为:BD.
点评 本题综合考查电解质的电离,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含CO32- | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,原溶液可能存在Ag+或SO42-或CO32-或SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液的pD=7.0 | |
| B. | 含0.01 mol NaOD的D2O溶液1 L,其pD=12.0 | |
| C. | 溶解0.01 mol DCl于1 L D2O中,其pD=2.0 | |
| D. | 在100 mL 0.25 mol•L-1的DCl的D2O溶液中,加入50 mL 0.2 moL•L-1的NaOD重水溶液中,其pD=1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
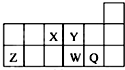
| A. | 元素Y的单质比元素X的单质更容易与氢气反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠与盐酸; 氢氧化钠与碳酸 | |
| B. | BaCl2溶液与Na2SO4溶液; Ba(OH)2溶液与H2SO4溶液 | |
| C. | Na2CO3溶液与硝酸溶液; CaCO3溶液与硝酸溶液 | |
| D. | 石灰石与硝酸反应; 石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示. (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 键能 |
| H-H | 436 |
| H-F | 565 |
| H-S | 339 |
| H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | B. | H(g)+F(g)→HF (g)+565kJ | ||
| C. | HF的热稳定性大于H2S | D. | H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com