
| A.①>②>③>④ | B.①>②>④>③ |
| C.①=②>③>④ | D.①=②>③=④ |
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:不详 题型:单选题
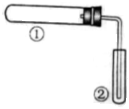
| | ①中实验 | ②中现象 |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
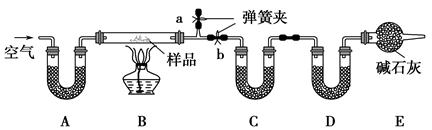
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取a克混合物充分加热,残留固体b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量Ba(OH)2溶液充分反应,最终得b克BaCO3 |
| D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
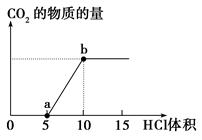
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.2:3 | D.3: 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它们的化学性质相似 | B.它们电子层数相同 |
| C.钠原子半径比钠离子半径小 | D.钠原子、钠离子均为同一元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
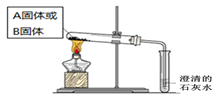
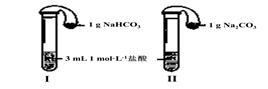
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com