
【题目】氮化铝(AlN)是一种新型无机材料,工业上由氧化铝与焦炭在氮气流中高温制得,产品中常含有Al4C3、C和Al2O3等杂质。某实验小组为测定a g工业氮化铝样品中AlN的质量及Al4C3的质量分数,设计了如下装置,已知装置B、C、D中的药品均足量。

已知:①AlN和Al4C3均能与水反应,分别生成NH3和CH4。②CH4能与CuO发生反应:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
(1)写出锥形瓶中发生反应的化学方程式。AlN与H2O反应:__________;Al4C3与H2O反应:____________。
(2)有下列操作步骤:①缓缓鼓入一定量的N2;②称量C和D(酒精灯和铁架台等除外)的质量,按顺序组装仪器,检查装置的气密性,将样品放入锥形瓶中;③点燃D处酒精灯;④再次称量C和D的质量;⑤从分液漏斗缓缓滴入水,直到不再产生气体时为止;⑥再次缓缓鼓入一定量的N2。正确的操作顺序是_________。
(3)C的作用是吸收氨气,则C中所盛试剂的最佳选择是________(填代号)。
A.蒸馏水 B.浓硝酸C.浓盐酸 D.浓硫酸
(4)A中反应结束后,还要通入一段时间的N2至D中固体恢复到室温,其目的是_______(写两条)。
(5)实验结束后,测得反应后D中固体质量减少m g,C中增加n g,则a g样品中AlN的质量为________g,Al4C3的质量分数为________×100%。
【答案】AlN+3H2O=Al(OH)3+NH3↑ Al4C3+12H2O=4Al(OH)3+3CH4↑ ②①③⑤⑥④ D 使生成的甲烷充分反应或生成的氨气完全被吸收或防止高温下铜与空气中的氧气反应,重新生成氧化铜 ![]() (或2.41n)
(或2.41n)![]()
![]()
【解析】
(1)依据已知条件AlN和Al4C3均能与水反应,分别生成NH3和CH4,结合水解原理作答;
(2)依据实验原理分析作答;
(3)氨气为碱性气体,需用酸性吸收剂,结合各物质物理性质分析;
(4)继续通入氮气,可使气体充分吸收,同时可防止氧气干扰实验;
(5)根据C中增重计算AlN的质量,根据D中质量差和方程式计算Al4C3的质量分数。
(1)AlN和Al4C3均能与水反应,分别生成NH3和CH4,则AlN与H2O反应生成氢氧化铝与氨气,其化学方程式为:AlN+3H2O=Al(OH)3+NH3↑;Al4C3与H2O反应生成氢氧化铝与甲烷,其化学方程式为:Al4C3+12H2O=4Al(OH)3+3CH4↑;
(2)由题意可知该实验的原理是:根据装置C的增重测定生成NH3的量,通过D中氧化铜粉末的质量变化测定CH4的量,实验前,首先称量C和D的质量,其次通入氮气排空气,再次点燃D处酒精灯,然后使样品与水反应,生成的氨气被C吸收,甲烷与氧化铜发生反应,最后,再通入氮气,使装置内的气体充分反应或被吸收,同时避免生成的铜重新被氧化,再次称量C和D的质量,所以正确的操作顺序为②①③⑤⑥④;
(3)浓硝酸和浓盐酸易挥发,会造成质量误差,所以B、C项错误;氨气虽然极易溶于水,但氨水易挥发,会造成质量误差,挥发出的氨气和水蒸气都会对D中实验造成干扰,A项错误;浓硫酸可吸收氨气,达到实验目的,D项正确;
故答案选D;
(4)A中反应结束后,还要通入一段时间的N2至D中固体恢复到室温,主要是为了使生成的甲烷充分反应或生成的氨气完全被吸收或防止高温下铜与空气中的氧气反应,重新生成氧化铜;
(5)装置C增加的质量即为氨气的质量,ng氨气的物质的量为![]() ,则根据N守恒,AlN的物质的量亦为
,则根据N守恒,AlN的物质的量亦为![]() ,质量为
,质量为![]() ×41g/mol=
×41g/mol=![]() (或2.41n)g;根据CH4+4CuO
(或2.41n)g;根据CH4+4CuO![]() 4Cu+CO2+2H2O和D中固体质量减少mg,可求得消耗CH4的物质的量为
4Cu+CO2+2H2O和D中固体质量减少mg,可求得消耗CH4的物质的量为![]() ,则根据C守恒,ag样品中含Al4C3的物质的量为
,则根据C守恒,ag样品中含Al4C3的物质的量为![]() ,其质量为
,其质量为![]() mol×144g/mol=
mol×144g/mol=![]() g,其质量分数为
g,其质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() (或2.41n);
(或2.41n);![]() 。
。


科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4 g ,
(1)若此有机物的质量为3 g,则此有机物的结构简式是_________________________;
(2)若此有机物的质量为4.6 g,则此有机物的分子式是________________________;
(3)若此有机物的质量为6.2 g,且此有机物1mol能和金属钠反应生成1 mol H2,则此有机物的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32—水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 纯碱溶液呈碱性的原因是CO32—+H2O![]() HCO3—+OH-
HCO3—+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a点溶液蒸发(不考虑溶质析出)c(Na+)/c(A-)增大
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(s),当
pC(g)+qD(s),当
m、n、p、q为任意整数时,反应达到平衡的标志是( )
①体系的压强不再改变 ②体系的温度不再改变 ③体系的密度不再变化 ④各组分质量分数不再改变
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素在农业、医药等诸多领域应用广泛。工业上有多种工艺用NH3和CO2直接合成尿素。
(1)水溶液全循环法合成尿素的反应过程可用下列热化学方程式表示:
反应I 2NH3(1) +CO2(g)NH2 COONH4(1) △H1 = - 119.2 kJmol-1
反应II NH2COONH4(1)CO(NH2)2(1)+ H2O(1) △H2= 15.5 kJmol-1
①写出NH3(1)与CO2(g)反应生成CO(NH2)2(1)和液态水的热化学方程式:______。
②该工艺要求在190~ 200℃、13 ~ 24 MPa 的条件下反应,90℃左右反应可实现最高平衡转化率。试解释选择高压条件的理由:_________。
(2)在不同氨碳比L=![]() 和水碳比W=
和水碳比W=![]() 条件下CO2平衡转化率x随温度T变化情况如图所示:
条件下CO2平衡转化率x随温度T变化情况如图所示:
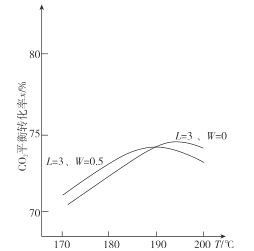
①CO2平衡转化率x随温度T升高先增大后减小,试分析原因:_________。
②在图中,画出L=4、W=O时CO2平衡转化率x随温度T变化的曲线示意图____。
(3)实验室模拟热气循环法合成尿素,T℃度时,将5.6mol NH3与5.2molCO2在容积恒定为0.5L的恒温密闭容器中发生反应:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O (g) △H1=—43kJmol-1。达到平衡状态时,NH3与CO2的平衡分压之比 p(NH3): p(CO2)= 2:13。[p(NH3)= x(NH3)p,x(NH3)为平衡体系中NH3的物质的量分数,p为平衡总压]。
①T ℃时,该反应的平衡常数 K = ______________。
②若不考虑副反应,对于该反应体系,下列说法正确的是 _________ 。
A.当反应体系中气体分子的平均摩尔质量保持不变时,反应达到平衡状态
B.相同条件下,提高水碳比或降低氨碳比都会使NH3 的平衡转化率降低
C.在容器中加入CaO,(可与 H2O反应),提高CO(NH2)2产率
D.反应开始后的一段时间内,适当升温可提高单位时间内CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请分析该反应中电子转移的情况(用双线桥表示)______。
(2)浓盐酸在反应中显示出来的性质是____(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若标准状况下产生4.48LCl2,被氧化的盐酸的物质的量为___mol,转移电子的物质的量_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,在化工、医药、农药等方面有广泛的应用。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,己知:CH3OH(g)![]() HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H
(1)该反应的能量变化如图甲所示,△H=___kJmol-1。

(2)为提高CH3OH转化率,采取的措施有___、___;在温恒容条件下,该反应达到平衡状态的标志有___(填标号)。
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为___(填标号),理由是___。
a.400℃ b.650℃ c.700℃ d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mo1甲醇,发生反应:
①CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
②CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
平衡时甲醇为0.2mol,甲醛为0.7mo1。则反应i的平衡常数K=___。
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为___:若收集到112mLCO2(标准状况),理论上转移电子___ mo1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com