
| A. | 硫酸铁可用作净水剂 | B. | 二氧化硅可用作计算机芯片 | ||
| C. | 铜制容器可用于盛装浓硝酸 | D. | 醋酸铅可用于分离提纯蛋白质 |
分析 A、硫酸铁溶液中铁离子水解生成氢氧化铁胶体具有吸附悬浮杂质作用;
B、硅是半导体做计算机芯片;
C、铜和浓硝酸发生反应;
D、醋酸铅溶液是重金属盐,能使蛋白质变性,变性是不可逆过程;
解答 解:A、硫酸铁溶液中铁离子水解生成氢氧化铁胶体具有吸附悬浮杂质作用,硫酸铁可用作净水剂,故A正确;
B、硅是半导体做计算机芯片,二氧化硅数光导纤维的材料,故B错误;
C、铜和浓硝酸发生反应,铜制容器不能用于盛装浓硝酸,故C错误;
D、醋酸铅溶液是重金属盐,能使蛋白质变性,变性是不可逆过程,不能用于分离提纯蛋白质;
故选A.
点评 本题考查了盐类水解,物质性质的分析应用,注意蛋白质的分离方法和性质判断,掌握基础是关键,题目较简单.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
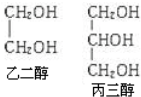
| A. | 某烷烃的名称为2-甲基-4-乙基戊烷 | |
| B. | 甲醇、乙二醇、丙三醇(结构如图)互为同系物 | |
| C. | 淀粉、纤维素、蔗糖都属于天然高分子化合物,而且水解产物中都有葡萄糖 | |
| D. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
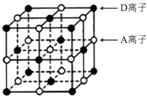 A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
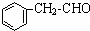 )主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90.
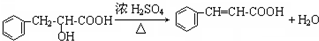
)主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90. $\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E
$\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E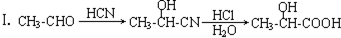
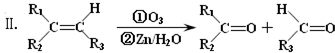
 ;该反应类型属消去反应.
;该反应类型属消去反应. 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com