
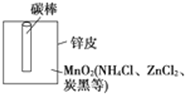
 某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质.整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质.整个实验过程如下,请回答有关问题:
| ||
| ||


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |
| A. | HNO2+HS-═NO2-+H2S↑ |
| B. | 2HCOOH+SO32-═2HCOO-+H2O+SO2↑ |
| C. | H2SO3+2HCOO-═2HCOOH+SO32- |
| D. | H2SO3+SO32-═2HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
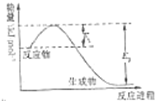 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.请回答下列问题:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
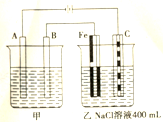 下图为相互串联的甲乙两个电解池,试回答:
下图为相互串联的甲乙两个电解池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com