
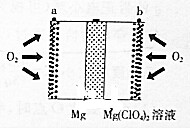
 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )| A. | 放电时Mg在负极被ClO4-氧化 | |
| B. | 正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 | |
| D. | 理论上外电路流过1mol电子时电池总质量增加8.0g |
分析 该原电池中,镁作负极,负极上镁失电子发生氧化反应,正极上氧气得电子发生还原反应O2+2H2O+4e-═4OH-,电池反应式为:2Mg+O2+2H2O═2Mg(OH)2,根据电池反应结合电子守恒来计算.
解答 解:A、放电时,金属镁在负极上发生失电子的氧化反应,但是不是被高氯酸根离子氧化,故A错误;
B、镁空气电池放电时,在正极上氧气得电子发生还原反应O2+2H2O+4e-═4OH-,故B正确;
C、电池反应式为:2Mg+O2+2H2O═2Mg(OH)2,故C正确;
D、根据电池反应式:2Mg+O2+2H2O═2Mg(OH)2,当外电路流过4mol电子时,电池总质量增加32g,当外电路流过4mol电子时,电池总质量增加8.0g,故D正确.
故选A.
点评 本题考查原电池(燃料电池)基本原理,为高频考点,侧重于学生的分析能力的考查,本题涉及电极判断、电极反应书写等相关知识,难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:实验题
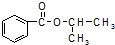 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
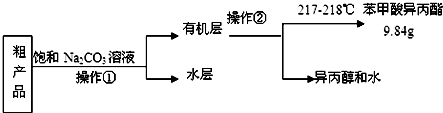
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
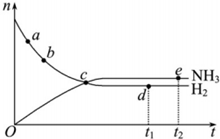 对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | a点、b点的正反应速率比逆反应速率大 | |
| B. | c点时每断裂3molH-H则断裂6molN-H | |
| C. | d点(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | v(N2):V (NH3)=1:2时达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
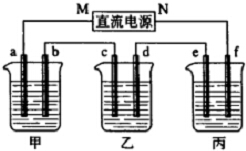 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量氢氧化钙溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 用石墨做电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向FeBr2溶液中通入等量的Cl2:2Br-+2Fe2++2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA | |
| B. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| C. | 0.1molFe与0.1mol氯气反应时失去的电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g,电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 单质的还原性:A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com