
襄阳五中某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设] 假设1:气体产物只有SO2; 假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
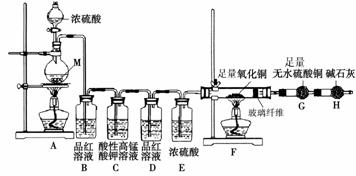
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后 ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式: ;
(3)若假设2正确,则可观察到:F管中 ;G干燥管里 。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法: 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为 。试写出烧瓶里发生反应的总化学方程式 。
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
向10mL 0.1mol· L−1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。下列有关说法正确的是
A.氢制备工艺廉价易行,且储存方便
B.燃料电池车中能量转化率为100%
C.燃料电池车可直接将化学能转化为电能
D.利用热电厂的电能电解蒸馏水制备氢气是一种环保之举
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列有关该反应的说法中正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列有关该反应的说法中正确的是
| t / min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |

A. 反应前2min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,达到平衡时,将容器体积缩小至5升,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒浓度关系判定不正确的是
A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在
c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1
B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
c(Na+) - c(F-) > c(K+) - c(CH3COO-)
C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:
c(K+) + c(H+) = c(CH3COO-) + c(OH-)
D.NaHSO3溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.镁、铝具有一定的抗腐蚀性,是因为镁、铝不易被氧化
C.84消毒液的主要成分是NaClO
D.某些金属元素的焰色反应、海水提溴、煤的液化、石油的裂化都是化学变化的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
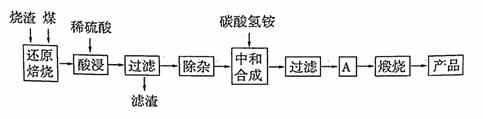
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是 (用离子方程式表示)。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,检验Fe3+已经除尽的试剂是 ;常温下,当pH = 5时,溶液中c(Al3+)
= mol·L– 1(已知常温下Ksp[Al(OH)3] = 2.0×10– 33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是 。
(5)a g烧渣经过上述工艺可得红氧化铁b g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含a、b的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.第三周期元素的离子半径从左到右逐渐减小
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com