
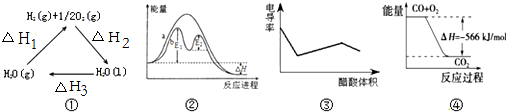
| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
分析 A、根据盖斯定律来分析;
B、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能;
C、醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答;
D、未指明是几摩尔CO燃烧放出566KJ的热量.
解答 解:A、根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,故A错误;
B、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故B错误;
C、氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,故C正确;
D、图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,故D错误;
故选C.
点评 本题考查了盖斯定律的应用,活化能概念应用,反应焓变的意义以及溶液的导电性等问题,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
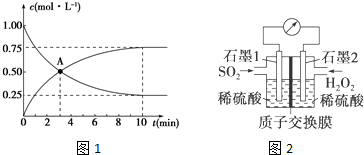
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, ,R的最简单氢化物的电子式为
,R的最简单氢化物的电子式为 ,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).
,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
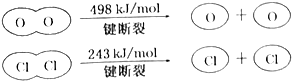
| A. | 反应A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O键比HCl中H-Cl键弱 | |
| C. | 由II中的数据判断氯元素的非金属性比氧元素强 | |
| D. | 断开1molH-O键与断开1molH-Cl键所需能量相差31.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
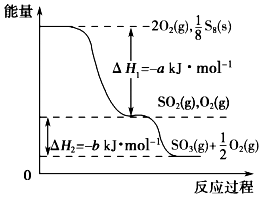 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com