
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:

(1)下列有关石墨烯说法正确的是________________。
A.键长:石墨烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含![]() 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为_____________;第四周期元素中,最外层电子数与铜相同的元素还有________________________。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______________________________。
③下列分子属于非极性分子的是__________________。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为________________。

⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):

它的化学式可表示为_____;在Au周围最近并距离相等的Cu有_____个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为___________________g/cm3。(阿伏伽德罗常数用NA表示)
【答案】 BD 3d K、Cr 乙醇分子间可形成氢键而丁烷分子间不能形成氢键 a、c sp2 2 Cu3Au或AuCu3 12 38921/21030/(NAd34)
【解析】(1)A.金刚石中碳原子之间只存在σ键,石墨烯中碳原子之间存在σ键和π键,因此键长:石墨烯<金刚石,故A错误;B.石墨烯是平面形分子,分子中所有原子可以处于同一平面,故B正确;C.一个碳原子中含有![]() 个单键,即
个单键,即![]() 个σ键,所以12g石墨烯含σ键数为
个σ键,所以12g石墨烯含σ键数为![]() NA,故C错误;D.石墨层内是共价键,石墨层与层之间的作用力是范德华力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力,故D正确;故选:BD;
NA,故C错误;D.石墨层内是共价键,石墨层与层之间的作用力是范德华力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力,故D正确;故选:BD;
(2)①铜原子在基态时的电子排布式为1s22s22p63s23p63d104s1,在有电子填充的能级中,能量最高的能级符号为3d;第四周期元素中,最外层电子数与铜相同的元素还有3d04s1和3d54s1,即K和Cr,故答案为:3d;K、Cr;
②乙醇分子间存在氢键,使得其溶沸点升高,而丁烷不存在氢键,故答案为:乙醇分子间存在氢键,使得其溶沸点升高,而丁烷不存在氢键;
③a.甲烷为正四面体,结构对称,正负电荷的中心重合,属于非极性分子,故a正确;b.二氯甲烷为四面体分子,结构不对称,正负电荷的中心不重合,属于极性分子,故b错误;c.苯为平面正六边形,结构对称,正负电荷的中心重合,属于非极性分子,故c正确;d.乙醇结构不对称,正负电荷的中心不重合,属于极性分子,故d错误;故选:ac;
④酞菁分子中碳原子含有3个σ键和1个π键,所以采取sp2杂化;该分子中能提供孤对电子的氮原子才是配位原子,所以酞菁铜分子中心原子的配位数为2,故答案为:sp2;2;
⑤该晶胞中含Cu原子个数=6×![]() =3,含有Au=8×
=3,含有Au=8×![]() =1,所以其化学式为Cu3Au或AuCu3,根据图示,铜原子周围最近并距离相等的Au原子有4个,根据化学式,在Au周围最近并距离相等的Cu有12个;若2个Cu原子核的最小距离为d pm,则晶胞的棱长为
=1,所以其化学式为Cu3Au或AuCu3,根据图示,铜原子周围最近并距离相等的Au原子有4个,根据化学式,在Au周围最近并距离相等的Cu有12个;若2个Cu原子核的最小距离为d pm,则晶胞的棱长为![]() d pm=
d pm=![]() d×10-10cm,该晶体的密度=
d×10-10cm,该晶体的密度=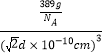 =
=![]() g/cm3,故答案为:Cu3Au或AuCu3;12;
g/cm3,故答案为:Cu3Au或AuCu3;12;![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物w用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:

已知![]()
请回答下列问题
(1)F的名称是__________⑤的反应类型是__________。
(2)E中的含氧官能团的名称为__________,W的结构简式为__________。
(3)反应②的化学方程式是__________。
(4)D自身还能发生聚合反应,其聚合产物的结构简式为__________。
(5)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(其他试剂任选) __________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可用蒸发结晶的方法从碘水中提取碘单质
B. 碘化银可用于人工降雨
C. 酒精在实验台上着火可用水作灭火剂
D. 氢气还原氧化铜要先加热再通氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①制备NO发生装置可以选用___________________(填写字母代号),请写出发生反应的离子方程式:___________________。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ __________________(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:


①实验室也可用X装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开 ____________,通入一段时间气体,其目的为___________________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为________________________。
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 __________溶液。
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
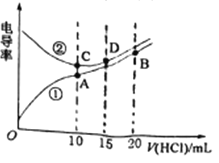
A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>B
B. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数Kb约为10-4
C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+]+2c[(CH3)2NH·H2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是

A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应
B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用
D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com