
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1molN2在一定条件下反应所得混合气体分子数大于2NA |
分析 A.n(Si)=$\frac{14g}{28g/mol}$=0.5mol,每个Si原子形成4个共价键;
B.n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,Na2O2晶体中含有钠离子和过氧根离子;
C.一个D2O分子中含有的质子数、电子数、中子数均为10,5g D2O的物质的量为$\frac{5g}{20g/mol}$mol=0.25mol;
D.氢气和氮气的反应为可逆反应.
解答 解:A.n(Si)=$\frac{14g}{28g/mol}$=0.5mol,每个Si原子形成4个共价键,则含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA,故A正确
B.Na2O2晶体中含有钠离子和过氧根离子,n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,含有的离子总数为0.15NA,故B错误;
C.一个D2O分子中含有的质子数、电子数、中子数均为10,5g D2O的物质的量为$\frac{5g}{20g/mol}$mol=0.25mol,所以5 g D2O含有的质子数、电子数、中子数均为2.5NA,故C正确;
D.3mol H2和1molN2在一定条件下如完全反应则可生成2mol氮气,但氢气和氮气的反应为可逆反应,则所得混合气体分子数大于2NA,故D正确.
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重考查学生的分析能力和计算能力,本题注意把握物质的构成特点以及相关计算公式的运用,难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
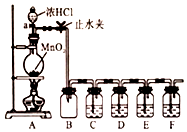 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| B. | 对2SO2+O2?2SO3△H<0的反应,使用催化剂可加快反应的速率 | |
| C. | 实验室可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,500℃左右比室温更有利于合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
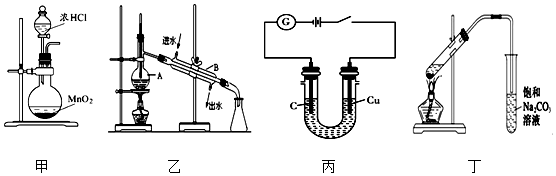
| A. | 利用装置甲制取氯气 | |
| B. | 利用装置乙分离乙酸(沸点:118℃)与乙酸乙酯(沸点:77.1℃) | |
| C. | 利用装置丙可电解食盐水制氯气和氢气 | |
| D. | 利用装置丁制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 标准状况下,lmol H2所占体积约为22.4L,lmol H2和N2混合气体的体积也约为22.4L | |
| C. | 0.1L0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA | |
| D. | 2.3gNa在足量O2中燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
工业生产水煤气的反应为:C(s)+H2O(g)→C O(g)+H2(g) △H=+131.4 kJ/mol下列判断正确的是
O(g)+H2(g) △H=+131.4 kJ/mol下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)→C(s)+H2O(g) △H=-131.4 kJ/mol
C.水煤气反应中生成1 g H2(g)吸收131.4 KJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 KJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com