
| A、pH相等的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH) |
| B、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2 CO3]<c(NH4Cl)、 |
| C、NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO3 2-)+c(H2RO3) |
| D、常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |


科目:高中化学 来源: 题型:
| A、K+、H+、SiO32-、SO42- |
| B、Na+、K+、OH-、SiO32- |
| C、Fe2+、Cl-、OH-、HCO3- |
| D、Na+、H+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂是H3AsO3,SnCl62-是氧化产物 |
| B、还原性:Cl->As |
| C、每生成1 mol As,反应中转移电子的物质的量为6 mol |
| D、M为OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是查看答案和解析>>
科目:高中化学 来源: 题型:
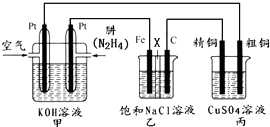
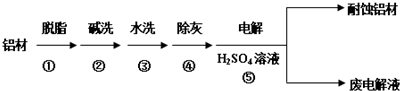
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | ||||
| B、铜片与浓HNO3反应:Cu+NO3-+2H+═Cu2++NO2↑+H2O | ||||
C、碳酸氢铵与足量NaOH溶液混合后加热:NH4++OH-
| ||||
D、铜片与浓硫酸共热:Cu+4H++SO42-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、只有①③ |
| C、只有②③ | D、只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.10 mol?L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) | ||||
| B、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、以KOH为电解质溶液的甲醇燃料电池的负极电极反应式:CH3OH-6e-+H2O=CO2↑+6H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com