
(10分)1 000 mL某待测液中除含有0.2 mol/L的Na+外,还可能含有下列离子中的一种或多种:
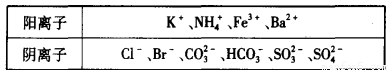
现进行如下实验操作(每次实验所加试剂均过量):
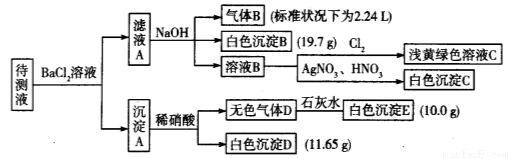
(1)写出生成白色沉淀B的离子方程式:___________________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
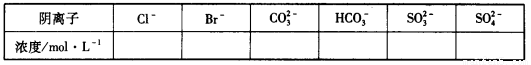
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:_______________________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
(1) Ba2+ + HCO3- + OH- = BaCO3↓ +H2O;(2) Fe3+、Ba2+;
(3)①(答对3空以上得1分,全对得2分)
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/mol/L | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
②存在;其最小的物质的量浓度为0.1 mol/L;
(4)①CO32- 、HCO3- 、SO32-; ②BaCO3 、BaSO3
【解析】
试题分析:向待测溶液中加入BaCl2溶液,形成白色沉淀A,向A中加入硝酸,会产生无色气体D及还有不是沉淀D,则证明该溶液中含有SO42-、CO32-,由于Ba2+与SO42-、CO32-会发生沉淀反应而不能大量共存,可确定在原溶液中不含有Ba2+;根据白色沉淀D可知:n(SO42-)=11.65g÷233g/mol=0.05mol;根据无色气体D形成的白色沉淀E,可知:n(CO32-)=10g÷100g/mol=0.1mol;向过滤得到的滤液中加入足量的NaOH溶液得到的气体的体积可知:n(NH4+)=0.1mol;同时还产生白色沉淀,则不含有Fe3+,则原溶液中还含有HCO3-,(1)发生反应的方程式是:Ba2+ + HCO3- + OH- = BaCO3↓ +H2O,n(HCO3-)=19.7g÷197g/mol=0.1mol;向滤液B中通入氯气,得到淡黄绿色溶液,证明在原溶液中不含有Br-,向滤液B中加入硝酸和AgNO3溶液,产生白色沉淀,只能证明在滤液B中含有Cl-离子,由于在前边加入了BaCl2溶液,所以不能证明原溶液中是否含有Cl-离子。(2) Fe3+与OH-会形成红褐色沉淀,因此不能存在;Ba2+与SO42-、CO32-不能共存,有SO42-、CO32-,因此也不能大量存在Ba2+;待测液中肯定不存在的阳离子是Fe3+、Ba2+;因此待测液中肯定不存在的阳离子是Fe3+、Ba2+;(3)若无色气体D是单一气体,则原溶液中一定不存在SO32-;①通过上述判断及计算各种阴离子的物质的量浓度关系表是:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/mol/L | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
②在溶液中电荷呈中性,2×n(SO42-)+1×n(HCO3-)+2×n(CO32-)=2×0.05mol+1×0.1mol+2×0.1mol =0.4mol;n(NH4+)+n(Na+)=0.1mol×1+0.2mol=0.3mol;由于阳离子所带的正电荷总数小于负电荷总数,所以一定含有阳离子K+;若原溶液中不存在Cl-,则Na+其物质的量是0.4mol-0.3mol=0.1mol,K+浓度是c(K+)=0.1mol÷1L=0.1mol/L,若存在Cl-,则K+的浓度应该大于0.1mol/L。故c(K+)≥0.1mol/L。(4)若无色气体D是混合气体,由于硝酸有强氧化性,能够把SO32-氧化,所以①待测液中一定含有的阴离子是:CO32- 、HCO3- 、SO32-;②则沉淀A中能与稀硝酸反应的成分是有还原性的BaSO3。
考点:考查溶液成分的确定、离子存在的检验、离子方程式的书写的知识。


科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:填空题
(每空2分,共12分)
PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl5(g)  PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
2L真空密闭容器中发生上述反应,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 |
n(PCl5) | 4 | 2.8 | 2 | 2 |
(1)已知上述反应在温度较高时才能自发进行,则a 0(填﹥、﹦、﹤);
(2)计算从20s至40s共20s的时间内,用PCl3表示的平均反应速率为 。210℃时该反应的平衡常数K值等于 。
(3)反应进行至60s后,将混合物的温度降低,重新达到平衡后氯气浓度将 (填“增大”、“减少”或“不变”)。
(4)欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
(5)如右图是210℃时容器中PCl5物质的量的变化曲线,请在该图中补画出该反应在160℃时PCl5物质的量的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍。下列说法不正确的是
A.N的单质的晶体属于金属晶体;U的氢化物的球棍模型示意图为
B.工业上V的单质的制备可以电解熔融的NV
C.Z的最高价氧化物对应的水化物能与其气态氢化物反应生成盐
D.X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物;也可形成结构式为X—W—Y ≡ Z的化合物
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为 X2- 和
Z- ,Y+ 和Z- 离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Y>Z
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量氨水 :Al3+ + 4NH3·H2O = [Al(OH)4]- + 4NH4+
B.澄清石灰水与过量苏打溶液反应: Ca2+ + HCO3-+ OH-= CaCO3↓+ H2O
C.碳酸钙溶于醋酸 CaCO3 + 2H+=Ca2+ +CO2↑+ H2O
D.氯化亚铁中通入氯气 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:
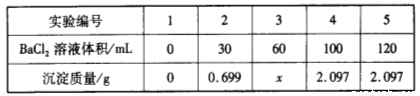
下列有关说法不正确的是( )
A.混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1
B.混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1
C.3号实验中沉淀的质量x为1.398 g
D.完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.1.0mol·L-1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42-
B.c(H+)/c(OH-)=10-11的溶液:Na+、Ba2+、NO3-、Cl-
C.滴入酚酞显红色的溶液:Ca2+、Al3+、NO3-、HCO3-
D.滴入碘化钾淀粉溶液显蓝色的溶液:Na+、Fe2+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法正确的是
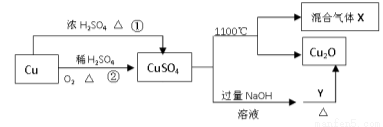
A.途径①和途径②都体现了硫酸的酸性和氧化性
B.Y可以是酒精溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com