
分析 (1)反应4min时,A的浓度减少为原来的$\frac{1}{3}$倍,则A反应了原来的$\frac{2}{3}$倍,根据vA=$\frac{△c}{△t}$,再根据vC=2vA计算vC;
(2)根据个物质的转化量之比,由反应之比等于化学计量数之比得m、q的值;
(3)根据反应计量数由D计算出B的转化量,再算转化率;
(4)压强增大,反应速率加快;
(5)A.根据ρ=$\frac{m}{V}$; B.反应是个体积改变的反应,压强不变到达平衡;C.混合气体的平均相对分子质量不变=$\frac{m}{n}$;D.容器内气体颜色深浅与浓度有关E.平衡状态时各物质的质量分数不变.
解答 解:(1)反应4min时,A的浓度减少为原来的$\frac{1}{3}$倍,则A反应了原来的$\frac{2}{3}$倍,vA=$\frac{△c}{△t}$=$\frac{\frac{xmol}{3L}×\frac{2}{3}}{4min}$=$\frac{x}{18}$mol/(L•min),vC=2vA=2×$\frac{x}{18}$mol/(L•min)=$\frac{x}{9}$mol/(L•min);
故答案为:$\frac{x}{18}$mol/(L•min);$\frac{x}{9}$mol/(L•min);
(2)由(1)知A反应$\frac{2}{3}$x,B的物质的量减少了x mol,C生成2×$\frac{2}{3}$x=$\frac{4}{3}$x,有2x mol D生成,则参与反应的物质的量之比为$\frac{2}{3}$x:x:$\frac{4}{3}$x:2x=2:3:4:6.反应为2A(g)+3B(g)?4C(g)+6D(g);
故答案为:2;6;
(3)6min时,反应达到平衡,D为2.4x mol,则反应的B有$\frac{1}{2}$×2.4x=1.2x,则B的转化率为$\frac{1.2x}{y}$×100%;
故答案为:$\frac{1.2x}{y}$×100%;
(4)将容器的容积变为1L,相当于压强增大,则反应速率增大;
故答案为:增大;将容器的容积变为1L,相当于压强增大,反应速率增大;
(5)A.混合气体密度ρ=$\frac{m}{V}$,物质均为气体,气体总质量不变,恒容体积不变,密度始终不变,不能说明达到平衡状态,所以A不可以;
B.该反应是个体积增大的反应,恒容压强会增大,容器内压强不变时达到平衡状态,所以B可以;
C.混合气体的平均相对分子质量=$\frac{{m}_{总}}{{n}_{总}}$,总质量不变,总物质的量变大,平均相对分子质量变小,当不变时,说明达到平衡状态,所以C可以;
D.若只有B是有色气体,则气体颜色深浅与浓度有关,容器内气体颜色深浅不变时,说明B的浓度恒定,达到平衡,所以D可以;
E.达到平衡时各物质的浓度百分量恒定,各物质的质量分数不变,所以E可以;
故答案为:A.
点评 本题考查化学平衡的计算,涉及反应速率的计算、转化率的计算、反应速率、平衡移动的影响因素及化学平衡状态的判断,综合性较强,注重高考常考考点的考查,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
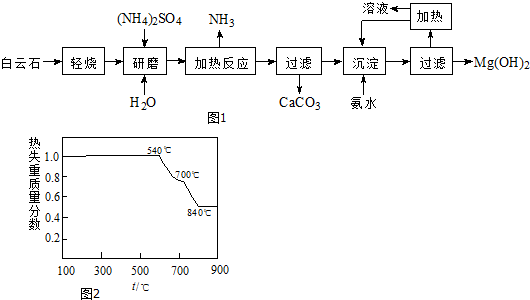
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
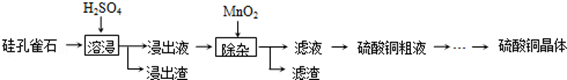
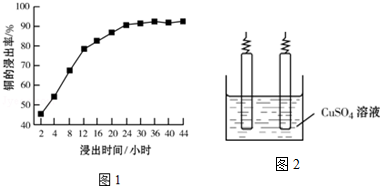
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
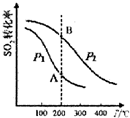 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com