
【题目】常温下,向10mL0.1mol·L-1KCl溶液和10mL0.1mol·L-1K2CrO4溶液中分别滴加0.1mol·L-1AgNO3溶液。滴加过程中pM[表示-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为砖红色沉淀,下列说法不合理的是
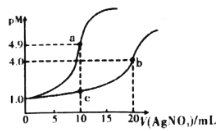
A.bc所在曲线对应K2CrO4溶液
B.常温下,Ksp(Ag2CrO4)<Ksp(AgCl)
C.溶液中c(Ag+)的大小:a点>b点
D.用0.1mol·L-1AgNO3标准液滴定上述KCl、K2CrO4溶液时,Cl-先沉淀
【答案】C
【解析】
由反应Cl-+Ag+=AgCl↓和CrO42-+2Ag+=Ag2CrO4↓分析,10mL0.1molL-1KCl溶液和10mL 0.1molL-1K2CrO4溶液中分别滴加等浓度的AgNO3溶液,当加入AgNO310mL时Cl-恰好完全沉淀,当加入AgNO3 20mL时,CrO42-沉淀完全,据此分析反应对应曲线。
A.常温下,向10mL0.1molL-1KCl溶液和10mL0.1molL-1K2CrO4溶液中分别滴加0.1molL-1AgNO3溶液,当加入10mLAgNO3溶液时,KCl恰好完全反应,加入20mLAgNO3溶液时K2CrO4恰好完全反应,因此a点所在曲线表示KCl溶液中变化的曲线,b、c点所在曲线表示K2CrO4溶液中的变化曲线,故A正确;
B.a点时恰好反应生成AgCl,由题图可知,此时-lgc(Cl-)=4.9,则溶液中c(Cl-)=1×10-4.9molL-1,c(Ag+)=![]() ,该温度下,Ksp(AgCl)=c(Cl-)×c(Ag+)=1×10-9.8,b点时恰好反应生成Ag2(CrO4),由题图可知,此时-lgc(CrO42-)=4.0,则溶液中c(CrO42-)=1×10-4 molL-1,c(Ag+)=2×10-4 molL-1,该温度下,Ksp(Ag2CrO4)=c(CrO42-)×c2(Ag+)=4×10-12,Ksp(Ag2CrO4)<Ksp(AgCl),故B正确;
,该温度下,Ksp(AgCl)=c(Cl-)×c(Ag+)=1×10-9.8,b点时恰好反应生成Ag2(CrO4),由题图可知,此时-lgc(CrO42-)=4.0,则溶液中c(CrO42-)=1×10-4 molL-1,c(Ag+)=2×10-4 molL-1,该温度下,Ksp(Ag2CrO4)=c(CrO42-)×c2(Ag+)=4×10-12,Ksp(Ag2CrO4)<Ksp(AgCl),故B正确;
C.溶液中a点c(Ag+)=1×10-4.9molL-1,b点c(Ag+)=2×10-4 molL-1,则a点<b点,故C错误;
D.用0.1mol·L-1AgNO3标准液滴定上述KCl、K2CrO4溶液时,对于KCl溶液c(Ag+)= ![]() =
= ![]() =1×10-8.8 molL-1,对于K2CrO4溶液c(Ag+)=
=1×10-8.8 molL-1,对于K2CrO4溶液c(Ag+)=![]() =
= ![]() =6.33×10-6 molL-1,则Cl-沉淀所需Ag+浓度小,Cl-先沉淀,故D正确;
=6.33×10-6 molL-1,则Cl-沉淀所需Ag+浓度小,Cl-先沉淀,故D正确;
答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是_____。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJmol-1
2NO2(g) △H=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJmol-1
2SO3(g) △H=-196.6kJmol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为_____。
②随温度升高,该反应化学平衡常数变化趋势是____。
(3)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是___。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水使有色布条褪色,说明氯水中含有![]()
B. 向氯水中加入![]() 溶液产生白色沉淀,说明氯水中含有
溶液产生白色沉淀,说明氯水中含有![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向氢氧化钠溶液中滴加氯水,溶液黄绿色消失,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体a逐滴加到固体b中,下列叙述正确的是
选项 | a | b | c | 现象 | 装置图 |
A | 浓H2SO4 | Cu | 澄清石灰水 | c中溶液变浑浊 |
|
B | 浓盐酸 | KMnO4晶体 | 紫色石蕊溶液 | c中溶液最终呈红色 | |
C | 稀HNO3 | Fe | NaOH溶液 | d中红棕色气体变浅 | |
D | 浓氨水 | 生石灰 | Al2(SO4)3溶液 | c中产生沉淀后溶解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷(![]() ),发生的反应如下。
),发生的反应如下。
主反应Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)
(g) ![]() =-210kJ·mol-1
=-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O)(l)
2CO2(g)+2H2O)(l)![]() =-1324kJ·mol-1
=-1324kJ·mol-1
Ⅲ.2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g)
4CO2(g)+4H2O(g)![]()
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)![]() =_________kJ·mol-1。
=_________kJ·mol-1。
(2)①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是_________________。

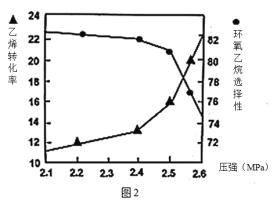
②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是__________________。
(3)实验测得反应Ⅰ中,v正=K正·x2(CH2=CH2)·x(O2),v逆=K逆·x2(![]() ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为___________。
②若平衡后仅升高温度,则下列说法正确的是___________。
a.x(CH2=CH2)增大,x(![]() )减小
)减小
b.K正与K逆的比值增大
c.v正减小,v逆增大
d.K正与K逆的比值减小
(4)将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2C],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如右图所示。
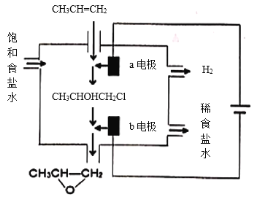
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为___________(选填“阴极”或“阳极”)。
②b电极区域生成环氧乙烷的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
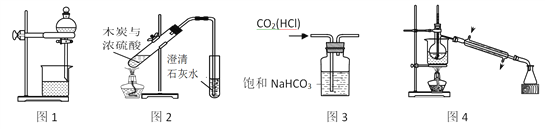
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是

A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com