

| A. | X试剂可用Na2SO3饱和溶液 | |
| B. | 步骤Ⅲ的离子反应:2Br-+Cl2═2Cl-+Br2 | |
| C. | 工业上每获得1molBr2,需要消耗Cl244.8L | |
| D. | 步骤Ⅳ包含萃取、分液和蒸馏 |
分析 A、亚硫酸根离子可以和氧化性的溴单质间发生氧化还原反应;
B、氯气具有氧化性,可已将溴离子氧化为溴单质;
C、根据氧化还原反应的方程式计算即可,标准状况每获得1molBr2,需要消耗标况下Cl222.4L;
D、溴单质在有机溶剂溶解度大,可以利用有机溶剂萃取溴单质,得到萃取液通过蒸馏得到纯溴.
解答 解:A、亚硫酸根离子可以和氧化性的溴单质间发生氧化还原反应,可以用所给物质来吸收溴单质,故A正确;
B、氯气具有氧化性,可以将溴离子氧化为溴单质,即2Br-+Cl2═2Cl-+Br2,故B正确;
C、发生2Br-+Cl2═2Cl-+Br2,每获得1molBr2,需要消耗标况下Cl222.4L,故C错误;
D、从溴水中提取溴可以采用萃取、分液和蒸馏的方法,故D正确.
故选C.
点评 本题考查学生还水体秀的基本原理以及物质分离和提纯的方法等方面的知识,注意知识的迁移和应用是解题关键,难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 欲将蛋白质从水中析出而又不改变它的性质,可加入AgNO3溶液 | |
| B. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 | |
| C. | 淀粉溶液中加入一定量稀硫酸,共热一段时间后,向溶液中加入新制氢氧化铜悬浊液并加热煮沸,未见红色固体产生,证明淀粉没有发生水解 | |
| D. | 可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | 金刚石晶体中的碳原子是sp2杂化的 | |
| C. | 12g金刚石中含有C-C键的个数为4NA | |
| D. | 金刚石化学性质稳定,即使在高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
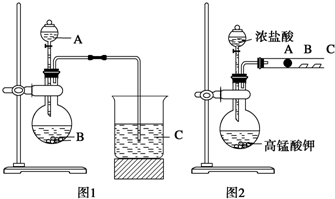
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
科目:高中化学 来源: 题型:解答题
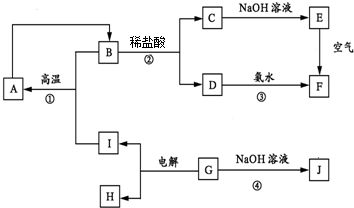
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com