
| A. | ${\;}_{22}^{48}Ti$和${\;}_{22}^{50}Ti$原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}Ti$和${\;}_{22}^{50}Ti$在元素周期表中占有相同的位置 | |
| C. | ${\;}_{22}^{48}Ti$和${\;}_{22}^{50}Ti$的物理性质相同 | |
| D. | ${\;}_{22}^{48}Ti$和${\;}_{22}^{50}Ti$为同一核素 |
分析 A.根据质量数=质子数+中子数,ZAX中的Z表示质子数,A表示质量数,求出中子数;
B.同位素是同一种元素,故在周期表中位置相同;
C.二者质子数相同,中子数不同,为同位素,物理性质不同,化学性质相同;
D.根据核素的概念来分析.
解答 解:A.因质量数=质子数+中子数,ZAX中的Z表示质子数,A表示质量数,所以2248Ti和2250Ti原子中中子数分别为26、28,故A错误;
B.同位素是同一种元素,故在周期表中位置相同,22号元素是第4周期第IVB族,故B正确;
C.2248Ti和2250Ti原子为同元素的不同原子,为元素同位素,化学性质相同,物理性质不同,故C错误;
D.因同一核素是质子数相同,中子数也相同的原子,2248Ti与2250Ti质子数相同为22,而中子数不同,故D错误.
故选B.
点评 本题考查了同位素在周期表中的位置,核素的概念,原子中质量数、中子数和质子数之间的关系,题目难度不大,注意质量数=质子数+中子数.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| 烯烃被氧化的部位 | CH2═ | RCH═ |  |
| 氧化产物 | CO2 | RCOOH |  |
 ),则该烯烃结构简式可能是( )
),则该烯烃结构简式可能是( )| A. |  | B. |  | ||
| C. | CH2=CH-CH=CHCH2CH3 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素单质的硬度和熔点 | |
| B. | 在AlCl3和MgCl2溶液中分别滴加少量的NaOH溶液 | |
| C. | 将打磨过的镁带和铝片分别与热水作用,并向其中滴入酚酞溶液 | |
| D. | 将空气中放置已久的26Al、26Mg的单质分别与热水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键在形成蛋白质结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子光谱可用于测定物质中元素的种类 | |
| C. | a粒子散射实验及布朗运动的发现都对原子模型建立做出了贡献 | |
| D. | X-射线衍射实验可以用来鉴别晶体和非晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )| A. | a为正极,b为负极;NaClO和NaCl | B. | a为负极,b为正极;NaClO和NaCl | ||
| C. | a为阳极,b为阴极;HClO和NaCl | D. | a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
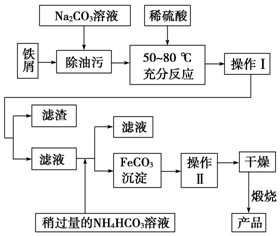 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 ;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.
;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com