
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足下图物质一步转化关系的选项是
选项 | X | Y | Z |
A | Na | Na2O2 | Na2CO3 |
B | Cu | CuCl2 | Cu(OH)2 |
C | Al | Al2O3 | Al(OH)3 |
D | Fe | FeCl3 | FeCl2 |
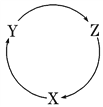
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
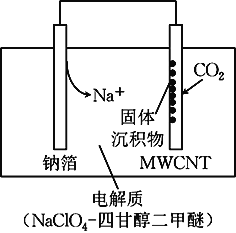
A. “吸入”CO2时,钠箔为正极
B. “吸入”CO2时的正极反应:4Na++ 3CO2+ 4e-= 2Na2CO3+ C
C. “呼出”CO2时,Na+向多壁碳纳米管电极移动
D. 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与 H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时φ(CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,平衡时φ(CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是
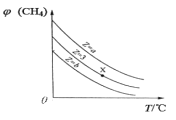
A. 该反应的焓变 ΔH>0
B. 图中 Z 的大小为 a>3>b
C. 图中 X 点对应的平衡混合物中![]()
D. 温度不变时,图中X 点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物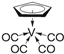 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。
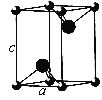
①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是
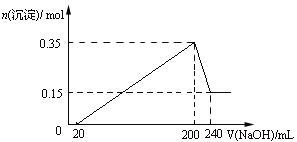
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因__________。
(2)基态氮原子中,核外电子占据的最高能层的符号为_______,核外电子能量最高的电子的电子云轮廓图形状为_________。
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为__________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如N5AsF6中存在高能量的N5+,N5+的空间构型为_______。(每个N原子都满足8电子稳定结构)
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中画出其晶胞_____,并写出该化合物的化学式_________。
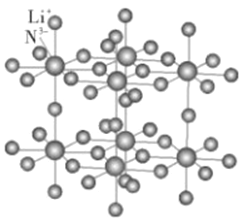
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
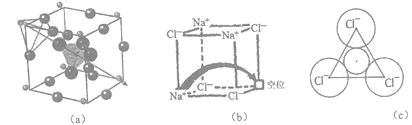
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com