
【题目】已知NA为阿伏伽德罗常数的值。下列说法不正确的是( )
A. 12g金刚石中平均含有2NA个σ键
B. 1mol SiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 1mol CH4中含4NA个s﹣p σ键
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示:

(1)请分别写出下列物质的化学式(如为溶液请填溶质的化学式):
A________、B________、D________。
(2)写出下列反应的化学方程式或离子方程式(请注明反应条件):
A+H2O(离子方程式):_____________;
A+石灰乳(化学方程式):______________;
E露置在空气中的第1个化学方程式:___________。
(3)漂白粉的有效成分是________(化学名称),保存漂白粉的方法__________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析不正确的是

A.b点溶液中OH-浓度在整个过程中最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.a点溶液显碱性,且离子浓度从大到小为:Na+>CO32->OH->HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)25 ℃下,0.1mol/L氨水的电离度为1%,则此温下,该溶液的pH=______。
(2)25 ℃下,pH=2的硫酸溶液Va mL与pH=10的NaOH溶液Vb mL恰好中和,则,Va:Vb=___________。
(3)某温下,水的离子积常数KW=1.0×10-13。该温下,0.2mol·L-1的NaHSO4溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合,混合后溶液的pH=______。
(4)一定条件下,可逆反应A2(g)+B2(g)2AB(g)达到化学平衡,经测定平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol.L-1,c(AB)=1.4 mol·L-1,若A2、B2、AB的起始浓度分别以a、b、c表示。请回答:
①a、b应满足的关系是_________。
②a的取值范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医药是中华民族的瑰宝,厚朴酚是一种常见中药的主要成分之一,有抗菌、消炎等功效,其结构简式如图a所示。下列说法错误的是
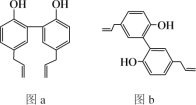
A.厚朴酚与溴水既可发生加成反应又可发生取代反应
B.图b所示为厚朴酚的一种同分异构体
C.厚朴酚分子中所有碳原子可能共平面
D.厚朴酚分子中不含手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图![]()
D. Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将10 mL 0.1 mol·L-1 NaA溶液逐滴加入10 mL 0.1 mol·L-1 HA溶液中,已知HA的电离平衡常数Ka = 1.8×10-4。下列说法正确的是
A.滴加过程中,混合溶液中![]() 始终变小
始终变小
B.滴加过程中,混合溶液中c(H+) + c(OH-) > 2.0×10-7 mol·L-1
C.充分混合后,溶液中A-的水解程度比原NaA溶液中A-的水解程度大
D.充分混合后,溶液中c(Na+) > c(A-) > c(HA) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)工业上利用Na2CO3溶液吸收NO、NO2混合气制备NaNO2,该反应可实现NO和NO2的完全转化,反应的化学方程式为________。
(2)NO2可发生二聚反应生成N2O4,化学方程式为![]() ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的![]() ________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数;
________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数; ![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随![]() 变化关系的是斜线________。
变化关系的是斜线________。
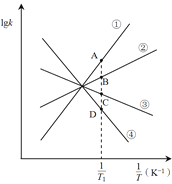
(3)图中A、B、C、D点的纵坐标分别为a + 1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=_______mol-1·L。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时υ正________υ逆(填>或<);上述反应达到平衡后,继续通入一定量的NO2,则NO2的平衡转化率将________,NO2的平衡浓度将________(填增大、减小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取不同质量样品溶于水后分别逐滴加入相同浓度盐酸30 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积)与加入样品的质量关系如图所示(不考虑CO2在水中的溶解、反应)。请计算:

(1)样品中n(Na2CO3) : n(NaHCO3)=____________。
(2)盐酸的物质的量浓度c(HCl)=________mol·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com