
【题目】相同温度,相同物质的量浓度的4种溶液( )
①CH3COONa ②NaHSO4 ③NaCl ④Na2CO3
按pH由大到小的顺序排列,正确的是
A.④>①>③>②B.①>④>③>②
C.①>②>③>④D.④>③>①>②
科目:高中化学 来源: 题型:
【题目】(1)从氧化还原的角度分析水在下列化学反应中的作用,将选项字母填入括号中。
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
①电解水:(____________)
②钠和水的反应(化学方程式:________________________):(____________)
③氟气和水反应(2F2+2H2O===4HF+O2):(____________)
④氯气和水反应(Cl2+H2O===HCl+HClO):(____________)
(2)将少量Cl2通入FeCl2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-, 这个事实说明具有还原性的粒子还原性强弱为________________。
(3)氯化铵常用作焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式______。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式),氧化产物是________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ mol的电子转移。
(4)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是___;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。
(1) 间接法:用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。
已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0KJ/mol
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0KJ/mol
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6KJ/mol
则H2和CO制液态甲醇的热化学方程式为_________。
(2)直接法: H2和CO2在特定条件下制甲醇的反应为:3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)。在某固定体积的密闭容器中充入一定量的H2和CO2,在催化剂、一定温度作用下(前30分钟内温度为T0 ℃),测得反应物浓度与时间的关系如下图所示。
CH3OH(g)+H2O(g)。在某固定体积的密闭容器中充入一定量的H2和CO2,在催化剂、一定温度作用下(前30分钟内温度为T0 ℃),测得反应物浓度与时间的关系如下图所示。
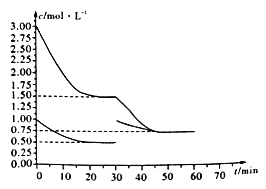
回答下列问题:
①该反应的化学平衡常数表达式K=_________;在T0℃反应达到平衡时,甲醇的体积分数为_________。(保留三位有效数字)
②保持温度和体积不变,下列情况可说明反应一定达到平衡状态的是_______。(填字母代号)
a.混合气体密度不变
b.反应体系压强不变
c.H2和 CO2的浓度之比为3:1
d.每断裂3mol的H-H键同时断裂3molC-H键
③其他条件不变,温度调至T1℃ (T1>T0),当反应达到平衡时测得平衡常数为K1(K10),则该反应为_____________(填“吸热反应”、“放热反应”)。
④在30分钟时,通过改变CO2的浓度(由0.5mol/L增至1.0mol/L),根据图示变化,通过计算说明只改变该条件能否建立45分钟时的平衡状态(K2)___________。(相关结果保留三位有效数字)
(3)甲醇可作燃料电池的原料,若电解质溶液为盐酸,当外电路转移12mol电子时(不考虑电子损失),将负极所产生的气体全部通入到2L 1.5mol/L的NaOH溶液中,充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是: ( )
①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓H2SO4溶液;④灼热的铜网;⑤碱石灰
A.①③④ B.②③④ C.②④③ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
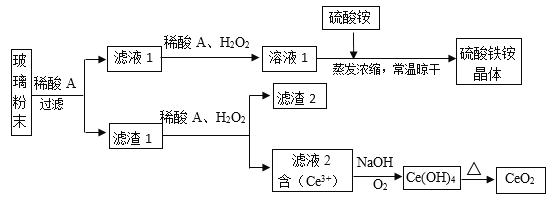
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式___________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气能发生氧化反应:4NH3+5O2=4NO+6H2O,改变下列条件使反应速率加大,其中是由于增大了“活化分子”的百分数的是( )
A. 增加NH3浓度 B. 缩小体积增大压强
C. 升高温度 D. 降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知质量分数为98%的浓硫酸,密度为1.84g/mL,下列有关说法不正确的是
A. 该硫酸物质的量浓度为18.4mol/L
B. 取10mL该溶液,加等质量的水混合后,所得硫酸物质的量浓度小于9.2mol/L
C. 取10g该溶液,加入等体积水混合后,所得硫酸质量百分比浓度大于49%
D. 将该硫酸盛放在U型干燥管中,可用来干燥H2、SO2、H2S等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,若使pH=3的盐酸与pH=9的Ba(0H)2溶液混合使其成为pH=7的溶液,混合时两溶液的体积比为( )。
A.1:60 B.3:1 C.100:l D.1:100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着环境问题的日益严重,垃圾的处理问题正日益被人们所重视.某垃圾处理厂对金属垃圾(主要成分是铁、铜、氧化铁、二氧化硅)处理及综合利用的部分工艺如图所示.请回答下列问题:
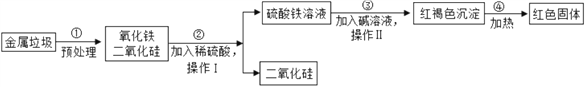
(1)I、II均含有_____操作,此操作中玻璃棒的作用是搅拌、____。操作II完成后红褐色沉淀洗涤的具体操作为_______。
(2)步骤③所发生的反应属于基本反应类型中的______。
(3)请写出步骤②、④所发生反应的化学方程式:
②_____________________________④ ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com