
| A. | ①②③⑤ | B. | ①③④⑥ | C. | ③④⑤⑥ | D. | 全部 |
科目:高中化学 来源: 题型:多选题
 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNAg/mol | |
| B. | Wg该原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| C. | Wg该原子中含有$\frac{w}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{b}{12}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2mol•L-1 | |
| B. | 该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L | |
| C. | 配制50mL 4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
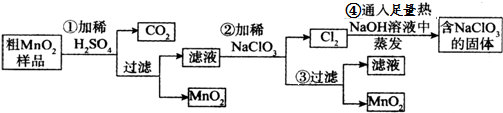
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ae | B. | aef | C. | abc | D. | ac |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
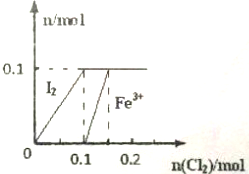 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com