
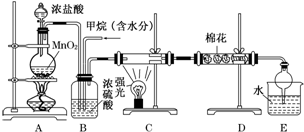
分析 实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,生成的黑色小颗粒为炭黑,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷,根据 上面的分析可知,在强光照射下,氯气与甲烷发生置换反应,也有氯化氢生成,所以E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应;
(2)浓硫酸可以干燥氯气和氯化氢;
(3)氯气能将碘化钾氧化为碘单质,碘单质遇到淀粉会变蓝色;
(4)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;
(5)CH4与Cl2发生取代反应时,一半的Cl进入HCl,一般的氯在有机物中,根据充分反应后生成CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,计算出各自的物质的量,进而计算所需氯气的物质的量.
解答 解:实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,生成的黑色小颗粒为炭黑,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷,反应方程式为CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,根据 上面的分析可知,在强光照射下,氯气与甲烷发生置换反应,也有氯化氢生成,所以E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,
故答案为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl;正确;
(2)浓硫酸可以干燥氯气和氯化氢,
故答案为:干燥氯气和氯化氢;
(3)氯气具有氧化性,KI中-1价的碘能被氯气氧化,产物为氯化钾固体和碘单质,所以棉花上均匀滴有足量淀粉KI溶液,能吸收过量的氯气,生成碘单质与淀粉在一起会变蓝色,所以棉花上可能预先滴有淀粉KI溶液溶液,
故答案为:淀粉KI溶液;
(4)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
故答案为:分液;
(5)根据充分反应后生成CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,可以设其物质的量分别是0.1mol、0.2mol、0.3mol、0.4mol;
四种有机取代物的物质的量之比为n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=1:2:3:4,发生取代反应时,一半的Cl进入HCl,消耗氯气的物质的量为0.1mol+2×0.2mol+3×0.3mol+4×0.4mol=3mol,生成HCl的物质的量共为1.5mol,
故答案为:3mol;1.5mol.
点评 本题考查了甲烷的取代反应原理,题目难度中等,注意掌握甲烷的化学性质,明确取代反应原理,(5)为易错点,注意甲烷与氯气的取代反应特点.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
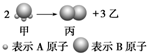 如图所示:已知甲、乙、丙常温下都为气体.
如图所示:已知甲、乙、丙常温下都为气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期 | B. | 第二周期 | C. | ⅤA族 | D. | ⅤⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的结构式为:O-C-O | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: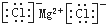 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol/(L•s)”表示的意思是:时间为1 s时,某物质的浓度为0.8 mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com