
���з�Ӧ�����ӷ���ʽ��ȷ����
A���������������������Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B���ں���Mn2+����Һ�м������ữ���ټ���PbO2����Ӧ��ϵ���Ϻ�ɫ
5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4�� + 2H2O
C��̼����狀�����������������Һ��Ӧ��NH4����OH����NH3����H2O
D������ˮ��Һ�ʼ��Ե�ԭ��S2-+2H2O  H2S��+2OH��
H2S��+2OH��
 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������˵����ȷ����
A��������ڹ��ۼ�
B����Ϊ���Ӽ���������Ե�ʣ�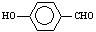 ��
��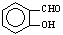 �۷е��
�۷е��
C����������ȷ��»���ǿ������H2O���ӱ�H2S�����ȶ�
D��1mol������4mol���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijʵ������Ҫ����240 mL 0.2 mol•L-1 ��Na2CO3��Һ���ش��������⣺
��1�������Na2CO3��10H2O������______ g��
��2������ʱ������������£�����ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ���
�� ��
A����30 mLˮϴ���ձ��Ͳ�����2��3�Σ�ϴ��Һ��ע������ƿ����
B���ó�ȡ����Na2CO3��10H2O ��������������ձ��У��ټ���������ˮ���ò���������������ʹ����ȫ�ܽ�
C��������ȴ����Һ�ز�����ע��250 mL������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���1��2 cm��
��3�����в�����ʹ������ҺŨ��ƫ�ߵ����� ����
A����ѡ�õ������Ѿ����ʣ����ֵ�ʧȥ�˽ᾧˮ
B��ת��ǰ������ƿ�к�����������ˮ
C����δ��ȴ����Һ�ز�����ע������ƿ��
D������ʱ�����ӿ̶���
E������ʱ�����Ϊ���������
F�����ݺ�ʹ��Һ���ȣ���ֹ�����ְ�Һ����ڿ̶��ߣ�����������ˮ���̶���
��4��ȡ�����Ƶ�̼������Һ125 mL���������125 mL 0.3 mol•L-1 ��������Һ������ַ�Ӧ�����ɵ������ڱ�״������ռ�����Ϊ���������������ȫ���ݳ���_________���跴Ӧ����Һ�����Ϊ250 mL����Ӧ����Һ��Na+�����ʵ���Ũ��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ҷ����׳Ʋ��ᣬΪ��Ԫ�ᣨ�ṹ��ʽΪHOOC��COOH���ɼ�дΪH2C2O4����25��ʱ������ĵ���ƽ�ⳣ��K1��5.0��10��2��K2��5.4��10��5��̼��ĵ���ƽ�ⳣ��K1��4.5��10��7��K2��4.7��10��11������Ƶ�Ksp��4.0��10��8��̼��Ƶ�Ksp��2.5��10��9���ش��������⣺
��1��д��ˮ��Һ�в���ĵ��뷽��ʽ�� ��
��2��25�棬���ʵ���Ũ�ȶ�Ϊ0.1 mol/L��Na2C2O4��Һ��pH��Na2CO3��ҺpH______________________�����С������ȡ�����
��3�������½�0.2 mol/L��KOH��Һ10 mL��0.2 mol/L�IJ�����Һ10 mL��ϣ��������Һ�����ԣ������Һ����������Ũ���ɴ�С��˳��____________________��
��4��25��ʱ��20 mL̼��Ƶı�����Һ����μ���1.0��10��3 mol/L�IJ������Һ20 mL���ܷ����������________________����ܡ�����
��5����ȥ��¯ˮ���е�CaSO4������̼������Һ�����������������ܽ⣬�䷴Ӧ�����ӷ���ʽ��______________________________��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ��������������ȷ����
A��T��ʱ��1LpH=6�Ĵ�ˮ�У����е�OH����ĿΪ1��10��6NA
B��12.0gNaHSO4�����к��е���������ĿΪ0.1NA
C��50g98%��Ũ�����У���������ԭ����ĿΪ2NA
D��1molNa2O2������CO2��ַ�Ӧת�Ƶĵ�����ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��Z��R�Ƕ���������Ԫ�أ�Xԭ�������������Ǵ�����������YԪ���ڵؿ��еĺ�����࣬ZԪ�صĻ��������ɫ��Ӧ�ʻ�ɫ��Rԭ�ӵĺ����������Xԭ����Zԭ�ӵĺ��������֮�͡�������������ȷ����
A��X��Y���γ����ֳ�������̬������
B��ԭ�Ӱ뾶�Ĵ�С˳��r��Z��> r��R��> r(X) > r(Y)
C��X��Z�ֱ���R�γɵĻ������л�ѧ�����Ͳ�ͬ
D������Y��Z��R����Ԫ�صĻ��������ֻ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijǿ������ҺX�к���Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32-��SO32-��SO42-��Cl����NO3-�е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�

����������Ϣ���ش��������⣺
��1�����������У���ҺX�г�H���һ�����е�������___________________����һ�������Ӳ���ȷ�����Ƿ���ڣ���Ҫ��ʵ��֤��������һ�������ڣ���������Ļ�ѧ������________________________________________________��
��2��д�����з�Ӧ�����ӷ���ʽ��
������������A��___________________________________________________��
�����ɳ���I��______________________________________________________��
��3������ⶨA��F��I��Ϊ0.01mol, 10mLX��Һ��n��H������0��04mol���Ҳ���ȷ�����е�����ֻ��һ�֡���X��Һ�в���ȷ����������_______ʱ������C���ʵ���_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ij�¶��£�NaOH���ܽ��Ϊ20�ˣ����¶��½�40��NaOH����110��ˮ�У���ֽ�������Һ���ܶ�Ϊ1.2g/mL������Һ�����ʵ����ʵ���Ũ��Ϊ�� ����
A��5.0mol/L B��0.02mol/L C��2.0mol/L D��0.8mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����(����)
A��þԭ�ӵ���������þ�����ԭ������
B��һ����ԭ�ӵ�ʵ������Լ����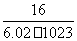 g
g
C��ˮ����Է�����������18 g
D�����������Ħ��������64 g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com