
| A、①④⑤⑦ | B、②⑤⑥⑦ |
| C、①③⑤⑥ | D、①③⑤⑦ |
| mg |
| 32g/mol |
| 6.4g |
| 32g/mol |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
| CO? | H? | CH?OH | H?O |
| 0.7mol?L-1 | 0.5mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、中和反应都是放热反应 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NH3与1mol OH-所含的质子数均为10NA |
| B、常温下,pH=13的NaOH溶液中含OH-数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、标准状况下,22.4L CHCl3中含C-H键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
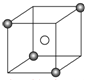 某离子晶体的晶胞结构如图所示,X(
某离子晶体的晶胞结构如图所示,X( )位于立方体的顶点,Y(○)位于立方体的中心.试分析:
)位于立方体的顶点,Y(○)位于立方体的中心.试分析:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HClO4>H2SO4>H3 PO4 |
| B、热稳定性:SiH4>PH3>H2 S |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、氧化性:F2>C12>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钡溶液反应:Ba2++SO42-?BaSO4↓ |
| B、稀盐酸滴在铜片上:Cu+2H+?Cu2++H2↑ |
| C、小苏打与氢氧化钠溶液混合:HCO3-+OH-?CO2↑+H2O |
| D、氧化铜与稀硫酸混合:CuO+2H+?Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com