某硫酸厂用接触法制硫酸:
(1)在煅烧黄铁矿时损失硫5%(质量分数,下同);在SO
2的催化氧化时,SO
3的产率为92%;在吸收塔中损失SO
30.6%.现有含FeS
295%的黄铁矿(杂质不含硫元素)100t,可制得98%的浓硫酸
t.
(2)若该厂每小时生产a t98%(质量分数)硫酸.为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%.若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则该厂每小时消耗标准状况下空气的体积为
m
3,b%的下限等于
.
(3)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO
2(循环利用)和混合铵盐.为测定此铵盐中氮元素的质量分数,将不同质量的铵盐样品分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.部分测定结果如下:
①铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同;
②铵盐质量为30.000g时,浓硫酸质量增重0.680g;
③铵盐质量为40.000g时,浓硫酸的质量不变.
通过计算推理求解该铵盐的成分和铵盐样品中氮元素的质量分数.(写出计算推理过程,计算结果用小数表示,并保留3位小数)



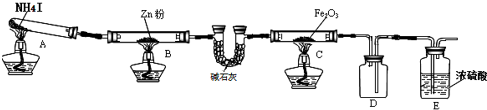
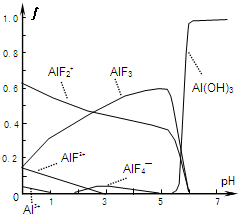 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是