(2012?奉贤区二模)为探究SO
2与可溶性钡盐能否反应生成白色BaSO
3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)
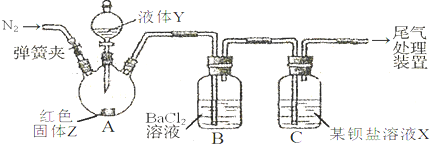
实验操作和现象:
| 操 作 |
现 象 |
| 关闭弹簧夹,滴加一定量液体Y,加强热; |
A中有白雾生成,红色固体Z的表面产生气泡.B中有气泡冒出,产生大量白色沉淀.C中产生白色沉淀,液面上方略显红棕色并逐渐消失. |
| 打开弹簧夹,通入气体N2,停止加热,一段时间后关闭; |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸. |
均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
.
(2)C中可溶性钡盐溶液X为
硝酸钡
硝酸钡
.实验过程中,发现液体Y不能很顺利地滴下,则可如何改进:
将分液漏斗改为恒压漏斗
将分液漏斗改为恒压漏斗
.
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是
空气参与了反应
空气参与了反应
,乙同学认为是白雾参与反应.为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N
2一段时间.乙同学则在A、B间增加盛有饱和NaHSO
3溶液的洗气瓶D.
甲、乙各自进行实验,B中现象分别如下表:由此得出的结论是
空气、白雾均是产生白色沉淀的原因,白雾是主要原因
空气、白雾均是产生白色沉淀的原因,白雾是主要原因
.
| 甲 |
大量不溶于稀盐酸的白色沉定 |
| 乙 |
少量不溶于稀盐酸的白色沉淀 |
(4)丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体.C中反应的化学方程式是
3SO2+2H2O+3Ba(NO3)2═3BaSO4↓+2NO↑+4HNO3
3SO2+2H2O+3Ba(NO3)2═3BaSO4↓+2NO↑+4HNO3
.
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO
2)
2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体.C中沉淀为
BaSO3、氢氧化铝
BaSO3、氢氧化铝
.实验室里欲获得该沉淀,所需要的玻璃仪器是
烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
.
(6)结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是
SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀
SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀
.

![]() SO
SO![]() 的质量为___________g。
的质量为___________g。 口算题天天练系列答案
口算题天天练系列答案
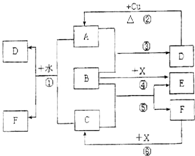 已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:
已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题: 无机化合物可根据其组成和性质进行分类,例如:(如右图所示)
无机化合物可根据其组成和性质进行分类,例如:(如右图所示) 2SO3
2SO3 2SO3
2SO3