
| A. | Fe | B. | O2 | C. | NaCl | D. | KNO3溶液 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质,无论电解质和非电解质都一定为化合物,单质和混合物一定不是电解质、非电解质;还要注意不属于电解质的物质包括非电解质、单质和混合物.
解答 解:A.铁为单质,既不是电解质也不是非电解质,故A错误;
B.氧气为单质,既不是电解质也不是非电解质,故A错误;
C.氯化钠在水溶液里或熔融状态下能导电的化合物,属于电解质,故C正确;
D.KNO3溶液是混合物,既不是电解质也不是非电解质,故D错误;
故选:C.
点评 本题考查了电解质与非电解质的判断,明确相关概念是解题关键,题目难度不大,注意掌握电解质与非电解质的区别.


科目:高中化学 来源: 题型:解答题
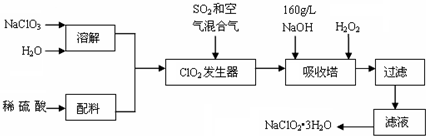
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O所含有的原子数为NA | |
| B. | 常温常压下,11.2LCl2所含的分子数为0.5NA | |
| C. | 常温常压下,32g O2含有的氧原子数为2NA | |
| D. | 1L0.1mol/LNa2SO4溶液中所含的Na+为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
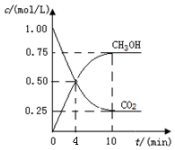 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
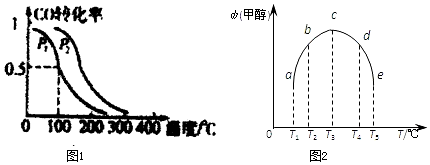
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com