
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:不详 题型:多选题
| A.铁红可用作红色涂料 |
| B.小苏打可用于治疗胃酸过多 |
| C.铁是地壳中含量最多的金属元素 |
| D.高压钠灯透雾性强,可用于公路两旁的照明灯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
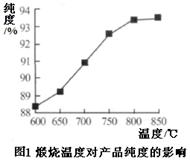
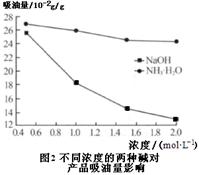
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
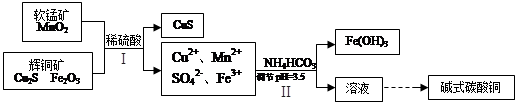
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
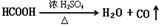 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.产物中硝酸铜的物质的量为0.025 mol |
| B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol |
| C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol |
| D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
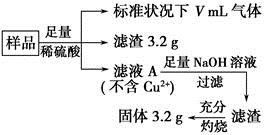
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B.样品中Fe元素的质量为2.24 g |
| C.样品中CuO的质量为4.0 g |
| D.V=896 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com