
【题目】目前的锂离子电池的正极材料多是LiCoO2、LiMn2O4、LiFePO4和双离子传递型聚合物等。改良正极材料的性能是锂离子电池领域的重点方向,如用碳包覆LiFePO4和向其中掺杂金属银等。下列过程是制备该正极材料的流程图:
![]()
回答下列问题:
(1)LiFePO4中铁元素的化合价为_____价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,C6H12O6的用量占原料总质量的5%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量为_______(保留两位小数)。
(2)将原料先行研磨4 h目的是_________。为了更快得到前驱体粉末,除了保持温度在50℃外,还应进行的常见操作方法是_________。
(3)两次焙烧均需要在高纯氮气环境下进行,原因是________。葡萄糖分解产生的碳除了提供还原性环境,提高产物纯度,而且可以阻止晶粒的聚集长大,控制颗粒形状,提高LiFePO4的电导率。则葡萄糖分解的化学反应方程式(分解过程中只有C一种单质生成)为________。600℃加热时硝酸银发生分解生成红棕色气体和3种常见单质(其中两种气体单质物质的量比为2:7),则分解时的化学反应方程式为_______。
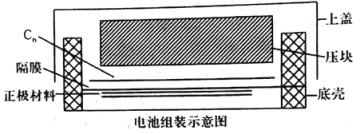
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是______、______(锂离子电池是靠xLi+在两极的嵌入和嵌出进行工作)。
【答案】+2 328.90g~329.07g之间 粉碎原料,增强后续过程中的焙烧效果 不断搅拌 防止碳的燃烧和+2价铁的氧化 C6H12O6![]() 6C+6H2O 6AgNO3
6C+6H2O 6AgNO3![]() 6Ag+2N2↑+7O2↑+2NO2↑ LiFePO4=xLi++Li1-xFePO4+xe- xLi++xe-+C6=LixC6(或Li++e-=Li等)
6Ag+2N2↑+7O2↑+2NO2↑ LiFePO4=xLi++Li1-xFePO4+xe- xLi++xe-+C6=LixC6(或Li++e-=Li等)
【解析】
(1)根据化合物中元素化合价代数和等于0,结合常见元素或原子团化合价确定Fe元素化合价;根据元素的物质的量的比,推断相应物质的物质的量的比及质量比,最后再根据总质量计算需要NH4H2PO4的质量;
(2)从固体与液体物质充分接触,提高接触面积对反应速率的影响分析;
(3)根据空气中的氧气有强氧化性分析;根据元素守恒,结合题目已知信息书写反应方程式;600℃加热时AgNO3发生分解生成红棕色气体是NO2,三种单质为Ag、N2、O2,其中两种气体单质的物质的量比为2:7,结合电子守恒分析可得分解时的化学反应方程式;
(4)充电时,正极连接电源正极为阳极,失去电子,发生氧化反应,负极连接电源负极为阴极,得到电子,发生还原反应,据此书写电极上所发生反应的电极反应式。
(1)在LiFePO4中,Li化合价为+1价,PO43-化合价为-3价,根据化合物中所有元素化合价代数和等于0,可知铁元素的化合价为+2价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,则根据物质含有的Li、Fe、P三种元素的原子守恒,可知Li2CO3、FeC2O4·2H2O、NH4H2PO4的物质的量的比是1:2:2,三种物质混合时质量比是37:180:115,由于C6H12O6的用量占原料总质量的5%,设其中含有葡萄糖质量为x,则![]() ×100%=5%,解得x=17.5 g,此时总质量m(总)=(x+37+180+115)g=349.5 g,其中NH4H2PO4的含量为:
×100%=5%,解得x=17.5 g,此时总质量m(总)=(x+37+180+115)g=349.5 g,其中NH4H2PO4的含量为:![]() ×100%=32.9%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量m=1000 g×32.9%=329.00 g。
×100%=32.9%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量m=1000 g×32.9%=329.00 g。
(2)将原料先行研磨4 h目的是粉碎原料,扩大固体的接触面积,增大反应速率,以增强后续过程中的焙烧效果。为了更快得到前驱体粉末,除了保持温度在50℃外,还进行的常见操作方法是搅拌;
(3)两次焙烧均需要在高纯氮气环境下进行,这是由于空气中含有的氧气具有强的氧化性,会将+2价的Fe氧化变为+3价,同时会使分解产生的C单质燃烧。在氮气环境,就可以防止碳的燃烧和+2价铁的氧化;葡萄糖受热分解产生C、H2O,反应方程式为:C6H12O6![]() 6C+6H2O;在600℃加热时AgNO3发生分解生成红棕色气体是NO2,同时还产生了三种常见单质Ag、N2、O2,其中两种气体单质N2、O2物质的量比为2:7,则根据电子守恒、原子守恒,可得该分解时的化学反应方程式为:6AgNO3
6C+6H2O;在600℃加热时AgNO3发生分解生成红棕色气体是NO2,同时还产生了三种常见单质Ag、N2、O2,其中两种气体单质N2、O2物质的量比为2:7,则根据电子守恒、原子守恒,可得该分解时的化学反应方程式为:6AgNO3![]() 6Ag+2N2↑+7O2↑+2NO2↑;
6Ag+2N2↑+7O2↑+2NO2↑;
(4)根据如图所示可知:充电时,电池正极连接电源正极,作阳极,失去电子,发生氧化反应,阳极的电极反应式为:LiFePO4-xe =xLi++Li1-xFePO4 -或写为LiFePO4=xLi++Li1-xFePO4+xe-;电池负极连接电源负极,作阴极,阴极上得到电子,发生还原反应,则阴极的电极反应式为:xLi++xe-+C6=LixC6(或Li++e-=Li等)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察,下列现象不可能出现的是( )
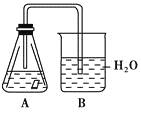
A.B中导气管中产生气泡B.B中导气管里形成一段水柱
C.金属片剪口变红D.锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
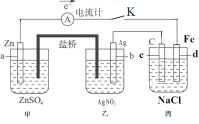
(1)乙中Ag电极的电极反应是___,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为___g;
(2)闭合电键K一段时间后,丙池中发生的总的化学方程式是___;
(3)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L此时测得丙池溶液质量实际减少3.75g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是___mol。
(4)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂。请回答下列问题:
(1)基态Ni原子价层电子的轨道表达式为__________________。
(2)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(3)![]() 因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与
因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与![]() 的结构密切相关,
的结构密切相关,![]() 的立体构型为________,P、O、S的电负性从大到小的顺序为_____,
的立体构型为________,P、O、S的电负性从大到小的顺序为_____,![]() 过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
A. B.
B.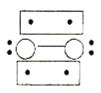 C.
C.![]() D.
D.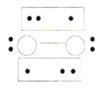
(4)![]() 易与
易与![]() 结合形成
结合形成![]() ,
,![]() 与
与![]() 间的化学键类型为________,若将配离子
间的化学键类型为________,若将配离子![]() 中的2个
中的2个![]() 换为
换为![]() ,2种结构,则
,2种结构,则![]() 是否为
是否为![]() 杂化________(填“是”或“否”),理由为_________________。
杂化________(填“是”或“否”),理由为_________________。
(5)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm。
的结构为体心立方堆积,晶胞参数为apm。![]() 中锰的原子半径为________pm。已知阿伏加德罗常数的值为
中锰的原子半径为________pm。已知阿伏加德罗常数的值为![]() ,
,![]() 的理论密度
的理论密度![]() ________
________![]() 。(列出计算式)
。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯甲醚是我国CB2760-86规定为允许使用的食用香料。常用于烘烤食品、软糖、冰冻乳制品。根据以下与其有关的合成有机物H的路线,回答问题。
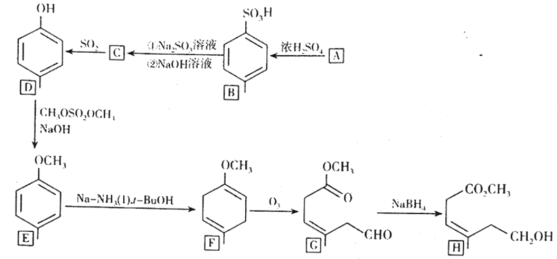
(1) 有机物A的名称是___,有机物C的结构简式是___。()
(2) E→F的反应类型是___,F→G的反应类型是___。
(3) 已知G→H的反应过程是,G先与NaBH4以物质的量比4:1发生加成反应,然后再水解生成H以及钠和硼的氢氧化物,则G→H的总化学方程式为___。
(4) 能与FeCl3溶液发生显色反应的E的同分异构体中,其苯环上的一氯取代物最多有___种。
(5) 已知 ,请结合题中信息设计由
,请结合题中信息设计由![]() 合成
合成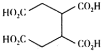 的合成路线(其他试剂任选):___。
的合成路线(其他试剂任选):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂皮是肉桂树的树皮,常被用作药物和食用香料,有效成分为肉桂醛。从肉桂皮中提取肉桂醛的主要流程如下:

下列说法不正确的是
A.肉桂醛可用作食品添加剂且不应过量
B.肉桂醛可溶于乙醇
C.红外光谱可检测出肉桂醛分子中含有碳碳双键和醛基
D.肉桂醛长期置于空气中容易发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。Cu和Zn在元素周期表中位于_____区,请写出基态Cu原子的价电子排布式_______________。第一电离能Il(Zn)_______Il(Cu)(填“大于”或“小于”),原因是________。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式,请分析1个松脂酸铜中π键的个数是______,加“*”碳原子的杂化方式为________。
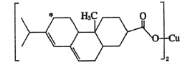
(3)硫酸铜溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
①在[Cu(NH3)4]2+中Cu2+、NH3之间形成的化学键为____,提供孤电子对的成键原子是______。
②![]() 立体构型是_____________。
立体构型是_____________。
③NH3的沸点 _________(填“高于”或“低于”)PH3;
(4)一种铜镍合金(俗称白铜)的晶胞如下图所示,铜、镍原子个数比为__________。
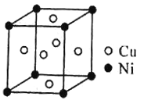
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com