
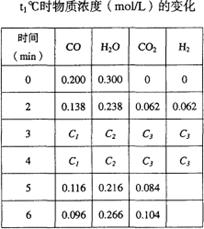
 CO2(g)��H2 (g)
CO2(g)��H2 (g)| ʱ�� / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
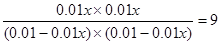 �����x��0.75����ת������75���������¶�ƽ�ⳣ������˵�������¶ȣ�ƽ��������Ӧ�����ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��
�����x��0.75����ת������75���������¶�ƽ�ⳣ������˵�������¶ȣ�ƽ��������Ӧ�����ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��

 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)����2s ����C��Ũ��Ϊ0.6mol?L-1�������м���˵�����в���ȷ����
2C(g)����2s ����C��Ũ��Ϊ0.6mol?L-1�������м���˵�����в���ȷ���� | A��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol?L-1?s-1 |
| B��2sʱ��ѹǿ����ʼʱ��1.1�� |
| C��2sʱ����A��ת����Ϊ30% |
| D��2sʱ����B��Ũ��Ϊ0.7 mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g)��H2(g)���÷�Ӧ�Ƿ��ȷ�Ӧ
CO2(g)��H2(g)���÷�Ӧ�Ƿ��ȷ�Ӧ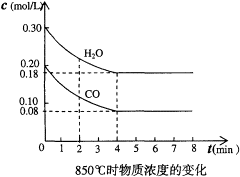
| A������ˮ���� | B�������¶� | C��ʹ�ô��� | D����������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3(g)�ﵽƽ��ı�־��
2AB3(g)�ﵽƽ��ı�־��| A��������ÿ����1mol A2��ͬʱ����2mol AB3 |
| B��������ÿ����1mol A2��ͬʱ����3mol B2 |
| C����������ܵ����ʵ��� |
| D���ܱ������ڵ����ʵ��������ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Ȼ�����Һ�м���һ������Ũ���ᣬ��Һ��ɫ�ı仯���ɷۺ�ɫ��Ϊ��ɫ |
B����֪I3�� I2 + I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� I2 + I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
| C���ڡ���п��Ƥ�ĶƲ��ȵIJⶨ��ʵ���У�����п��Ƥ����ϡ���ᣬ����������������ͻȻ��С�������ж�п�Ʋ��ѷ�Ӧ��ȫ |
| D���궨NaOH��Һ�Ļ����ʿ��ò��ᡢ�����ᡢ�ڱ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O3(g)+O2(g), ��N2O3(g)
N2O3(g)+O2(g), ��N2O3(g) N2O(g)+O2(g).���ݻ�Ϊ2L���ܱ������г���8mol N2O5,���ȵ�t��,�ﵽƽ��״̬��O2Ϊ9mol,N2O3Ϊ3.4mol.��t��ʱ��Ӧ�ٵ�ƽ�ⳣ��Ϊ����
N2O(g)+O2(g).���ݻ�Ϊ2L���ܱ������г���8mol N2O5,���ȵ�t��,�ﵽƽ��״̬��O2Ϊ9mol,N2O3Ϊ3.4mol.��t��ʱ��Ӧ�ٵ�ƽ�ⳣ��Ϊ����| A��10.7 | B��8.5 | C��9.6 | D��10.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
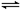 CO2(g)��H2(g)����Ӧ��CO�����ʵ����ڲ�ͬ�¶�ʱ���ʵ�����ʱ��ı仯���±���ʾ���ش��������⣺
CO2(g)��H2(g)����Ӧ��CO�����ʵ����ڲ�ͬ�¶�ʱ���ʵ�����ʱ��ı仯���±���ʾ���ش��������⣺| | 0min | 10min | 20min | 30min | 40min | 50min |
| 830�� | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100�� | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3����һ������Ӧ���ȵĿ��淴Ӧ�������й�˵���д�����ǣ� ��
2SO3����һ������Ӧ���ȵĿ��淴Ӧ�������й�˵���д�����ǣ� ��| A��ʹ�ô�����Ϊ�˼ӿ췴Ӧ���ʣ��������Ч�� |
| B�����������£�SO2������100��ת��ΪSO3�� |
| C���ﵽƽ��״̬ʱ��SO2Ũ����SO3Ũ����� |
| D���ﵽƽ��״̬ʱ��SO2������������SO2������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com