
【题目】已知:H2(g)+Cl2(g)![]() 2HCl(g)的反应能量变化示意图如下。下列说法不正确的是
2HCl(g)的反应能量变化示意图如下。下列说法不正确的是

A. 键的断裂过程是吸热过程,键的形成过程是放热过程
B. “假想的中间物质”的总能量高于起始态H2和Cl2的总能量
C. 反应的△H=[(a+b)-2c]kJ/mol
D. 点燃条件和光照条件下,反应的△H不同
【答案】D
【解析】
A.据图可知,要发生化学反应,首先使反应物分子变为单个原子,然后重新组合形成生成物分子,断裂化学键吸收能量,形成化学键释放能量,若能量以热能形式体现,则键的断裂过程是吸热过程,键的形成过程是放热过程,A正确;
B.断裂化学键吸收能量,形成化学键释放能量,则单个原子的能量比参加反应的化合物分子的能量要高,即“假想的中间物质”的总能量高于起始态H2和Cl2的总能量,B正确;
C.焓变等于断裂化学键吸收的能量减去成键释放的能量,则反应的△H为[(a+b)-2c]kJ/mol,C正确;
D.焓变与反应条件无关,只与物质的始态和终态有关,所以无论是点燃条件还是光照条件下,反应的△H都相同,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】下列溶液中能用来区别SO2和CO2的是( )
①石灰水 ②紫色石蕊试液 ③氯水 ④品红溶液 ⑤酸性KMnO4
A. ③④⑤B. ①②③C. ①⑤D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。

①该反应自发进行的条件是________(填“低温”、“高温”或“任意温度”)
②506K时,反应平衡时H2的转化率为________;压强:p1________(填“>”“<”或“=”)p2。
③反应速率:N点v正(CO)________(填“>”“<”或“=”)M点v逆(CO)。
(4)已知常温下,H2A在水中存在以下平衡:H2A![]() H++HA﹣,HA﹣
H++HA﹣,HA﹣![]() H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要配制500 mL 1 mol·L-1硫酸溶液。
(1)需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸________mL。
有如下操作步骤:
①把量好的浓硫酸沿烧杯壁慢慢注入蒸馏水中,并用玻璃棒搅拌溶解。
②把①所得溶液冷却后小心转入500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(2)操作步骤的正确顺序为______________(填序号)。
(3)本实验必须用到的玻璃仪器有10ml量筒、玻璃棒、烧杯、_________。
(4)下列情况使所配溶液的浓度偏高的是_________
A.某同学观察液面的情况如图所示

B.没有进行操作步骤④;
C.加蒸馏水时不慎超过了刻度线,再吸出一部分水。
D.向容量瓶中转移溶液时(操作步骤②)溶液流到容量瓶外面
(5)若实验过程中出现(4)中D选项情况应如何处理?:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
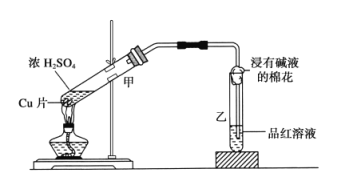
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会进步:
(1)玻璃是常见的硅酸盐产品,制玻璃发生的主要反应为_________,__________。
(2)钢化玻璃是一种常见的玻璃产品,其主要成分为_______________。
我们看到的玻璃,一般都呈淡绿色,只是因为原料中混有____________。
(3)插座也是一种塑料,它有绝缘性好,耐热,抗水等优点。它属于热____性塑料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式如图所示:

⑴维生素C分子中—OH原子团的名称是__________________;维生素C__________________溶于水(填“易”或“难”),属于________________ 维生素(填“脂溶性”或“水溶性”)。
⑵维生素C又被称为抗坏血酸,它能促进胶原蛋白形成,所以能防治_____________
⑶一个人每天摄入约100mg维生素C就能满足需要,下列物质中含有丰富维生素C的是____
A.苦瓜 B.鸡蛋 C.豆腐 D.沙丁鱼
⑷“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话说明:维生素C具有_____________性(填“氧化性”或“还原性”);维生素C在这一反应中发生了_____________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com